给血管内皮细胞模拟体内流体环境
细胞剪切力实验--流体剪切力为多功能干细胞来源的内皮细胞提供真实的模拟条件
美国的科研人员希望能够通过诱导多功能干细胞来源的内皮细胞(iPSC-EC)建立一个血管发育的模型。其中,对内皮细胞的剪切力是,血管发育中不可或缺的条件。流体剪切力能够使细胞排列紧密,有规律。这里以iPSC-EC细胞为例,使用ibidi Pump System 进行一个流动剪切力条件下的细胞培养与静置状态下的细胞培养的对比实验。
一、实验准备实验材料及设备
1)细胞: iPSC-EC (CDI, Madison,WI)
2)培养基:VascuLife VEGF Medium(Lifeline Cell Technologies, Frederick, MD)
3)培养耗材:ibidi单通道载玻片μ-Slide I0.6 Luer (ibidi,Germany,80186)
灌流管,15cm,1.6mm直径(ibidi,Germany,10962)
封口夹
4)仪器设备:ibidi流体剪切力系统,含空气泵(ibidi,Germany,10905)和流体单元(ibidi,Germany,10903)
二、实验方法
在实验开始前一天,请将所有需要使用的试剂,培养基,通道载玻片,灌流管都在37℃的二氧化碳培养箱中放置过夜,排除由于温度差产生的微量气泡。
一)按照下面流程铺细胞:
1)将1×105 cells/cm2密度的细胞悬液加入通道载玻片中,注意,将移液器头插入注液孔中再加入细胞悬液,可以轻微倾斜通道载玻片帮助细胞悬液充满整个通道(图一)。
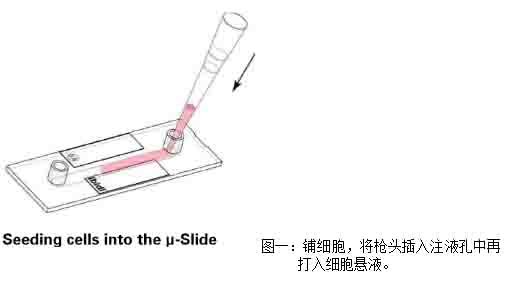
2)盖上注液孔盖,将通道载玻片放入细胞培养箱中培养半小时,等待细胞贴壁。细胞贴壁后,拿出通道载玻片,在每个注液孔中分别加入60μl培养基,注意,枪头要悬在孔上方滴入培养基(图二)
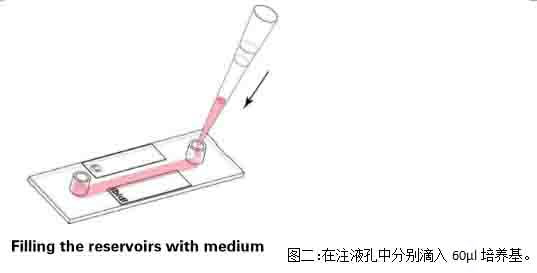
3)将通道载玻片再放入二氧化碳培养箱进行培养2-4小时左右,等到细胞刚刚长满为单细胞层,即可开始实验(图三)。注意,要使用单层细胞进行剪切力实验,使每个细胞均受到均匀的剪切力。
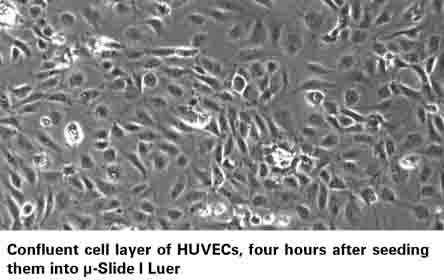
图三
4)静置条件下细胞培养。在通道载玻片中静置培养的细胞可以作为流体剪切力条件下培养的细胞对照。待流体实验开始的同时,将静置细胞培养的对照组放入二氧化碳培养箱中进行72h的培养。注意,培养过程中每天都要更换培养基。
二)搭建流体系统
1)将灌流管按照说明放在置在流体单元上。在灌流管的储液管中加入12ml培养基。这时不需要连接通道载玻片。实验前需要去除整个灌流管中的气泡,存留在灌流系统的气泡会影响剪切力的大小,有时还会使灌流系统中的液体流动停滞。打开ibidi泵控制系统,在任务栏中找到“Remove air bubbles”,ibidi流体剪切力系统将自动运行下面任务,用于去除气泡。(表一)

2)连接通道载玻片。去除气泡后,就可以将之前准备好的含贴壁细胞的通道载玻片与灌流管相连。将搭载灌流管的流体单元从流体剪切力系统中取下,放到超净台中。将通道载玻片的注液孔用培养基装至过满状态( )。之后就按照下面的流程图连接通道载玻片(图四)。
)。之后就按照下面的流程图连接通道载玻片(图四)。
图四:a)封口夹轻轻将灌流管的硅胶管夹住。b)将其中一个鲁尔接头从中间的链接管中拔出。c-j)按图示,将鲁尔接头与通道载玻片的注液孔相连,注意不能产生气泡,会有部分培养基溢出。k)连接好后,将封口夹移除,用无尘纸将溢出的培养基擦除。l)全部连接好后,用显微镜观测一下通道内的细胞状态。
3)检查灌流系统是否密封、是否将灌流管插入了正确的阀门。将封口夹夹住其中一根硅胶管,如果两边的灌流储液管液面不会下降或者上升,那么,整个系统就是密封的,并且是正确安装的(图五)。
图五
4)开始流体剪切力实验(单向层流)。将搭建好的流体单元与流体剪切力泵相连后,将整个流体单元放入二氧化碳培养箱中。打开控制软件,设置20 dyn/cm2 培养72h。
三)免疫荧光实验
1)去除通道内培养基。用1mlPBS冲洗通道,在注入PBS的同时,用枪头从另一个注液孔吸出废液。
2)加入约200μl的4%多聚甲醛的PBS溶液,用枪头从另一个注液孔吸出废液。静置10分钟。
3)按照步骤1)冲洗通道
4)加入200μl 1% Triton® X-100 的PBS 溶液通透3-5分钟
5)按照步骤1)冲洗通道
6)加入200μl 1% BSA的PBS溶液封闭20分钟
7)按照步骤1)冲洗通道
8)依次加入一抗,二抗进行免疫荧光染色后,冲洗通道并加入封片液进行显微镜观察。
三 实验结果
一)形态对比
在培养7天之后,可以直接用显微镜观察到细胞的形态发生了显著的变化,在剪切力刺激下培养的细胞形态更加修长,排列更加紧密和规律。而静置状态下培养了7天的细胞形态没有显著的变化(图六)。
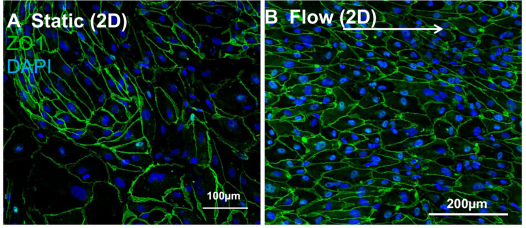
图六:如上所示,在20 dyn/cm2刺激下的细胞更为修长排列更加紧密。细胞核;蓝色;绿色:VE- cadherins。




 )。之后就按照下面的流程图连接通道载玻片(图四)。
)。之后就按照下面的流程图连接通道载玻片(图四)。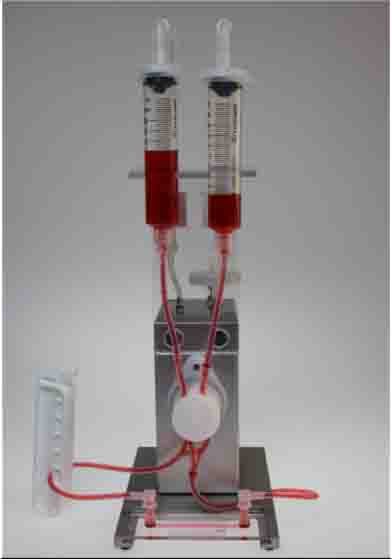


 沪公网安备31011202005471
沪公网安备31011202005471