活细胞骨架染色:实时观察3D细胞培养微环境与细胞迁移的互作用
活细胞骨架染色--实时观察3D细胞培养微环境与细胞迁移的互作用
2D细胞外基质(ECMs)的物理特性会影响到细胞的粘附动态和形态,但是3D细胞外基质的局部微环境对细胞的影响却知之甚少。美国的科研人员构建了几种3D胶原基质,研究其微结构的变化对于调节3D状态下的细胞粘附动态和细胞迁移的影响。细胞外基质中有各种成束的纤维会加强局部可粘位点的坚固性,并且可以通过ECM/粘附偶联点增强细胞的粘附稳定性,并且高度柔软的网状联合促进了粘附的收缩力。3D粘附的动力学由局部的ECM的强度和整合素/ECM还有II型肌球蛋的收缩白共同调节。不同于2D迁移,3D的细胞迁移不仅受ECM孔径大小影响。
科研人员需要观察活细胞的在成束的纤维中细胞前沿的突出点的形态变化,和细胞运动的轨迹。使用LifeAct标记细胞的F-actin能够不影响细胞功能和行为的情况下对细胞进行观测。研究人员发现细胞会将细胞前进的边缘沿着成束的纤维长边移动。具有接触导向的作用,这一点在纤维和细胞前进边缘平行时尤为明显。而纤维母细胞在不同的ECM中也显示出了类似的特性,是将纤维拉向细胞自身的同时将伪足向前延伸,并迁移的。
Local 3D matrix microenvironment regulates cell migration through spatiotemporal dynamics of contractility-dependent adhesions
Andrew D. Doyle,Nicole Carvajal,Albert Jin,Kazue Matsumoto& Kenneth M. Yamada
Nature Communications 6, Article number: 8720 doi:10.1038/ncomms
(一)实验材料
1) 细胞: fibroblast (gift from NIDCR/NIH)
2) 试剂: LifeAct-TagGFP2 质粒 (ibidi, Germany)
FBS (Hyclone)
L-glutamine (GIbco)
Anti-collagen I ( Millipore,1:200, Cat# ABT-123)
3) 仪器: 电转仪 (Bio-Rad Gene Pulsar TM)
(二)实验步骤
1、LifeAct-GFP转染
使用0.4cm的电击杯,设定电压为170V, 960uFd,持续时间17-22μs。
2、collagen I 预染
l 5ml 的3mg/ml的collagen1在室温固化
l 之后,胶置于50mM的硼酸盐缓冲液(pH 9.0)中孵育10min
l 室温避光条件下使用灌流管逐渐用含有NHS脂染料的硼酸盐溶液逐渐替换之前的缓冲液并孵育1小时。
l 保持染料一直处于灌流的状态,并且在孵育用TRIS溶液冲洗10分钟,并用PBS冲洗数小时移除没有结合的染料
l 使用200mM的盐酸溶解已凝固的胶知道所有的胶溶解
l 以1:1000的比例用20nM的冰醋酸透析上述胶溶液4小时
l 实验前,用标记过的collagen I替换2-4%的未标记的collagenI,并和细胞混匀,开始试验。
(三)实验结果
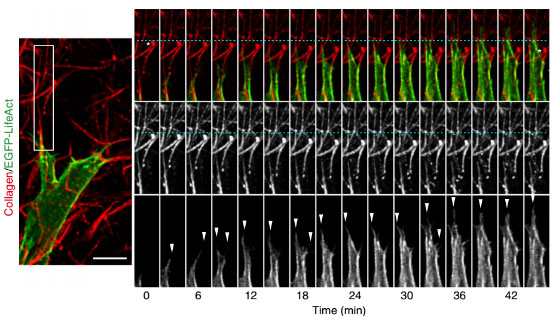
如图所示:表达EGFP-LifeAct的fibroblast(绿色或灰色)在FB4 ECM(红色)中的活细胞成像实验。从时间序列的拍摄结果可以看出,细胞一直是沿着纤维的方向,将actin富集到细胞的丝状伪足(白箭头)中,控制细胞的迁移方向。星号代表了一条胶原纤维起止位置,青色的线作为其位置的参照物表明,细胞是通过将纤维拉向自己的方式来向前移动的。

 沪公网安备31011202005471
沪公网安备31011202005471