在侵袭实验中,长时间追踪荧光标记的细胞对于研究细胞群体的迁移行为非常有益。当使用不表达报告染料的天然细胞系时,必须对细胞进行瞬时标记。然而,许多瞬时染料会影响细胞行为,并且只适用于短期显微镜成像,因为它们的强度会因降解、光漂白或细胞分裂而降低。超亮荧光纳米颗粒提供了一种很有前景的新方法。经过几个小时的短暂孵育期后,细胞会被生物相容且无毒的荧光纳米颗粒包裹,并可以连续成像以进行纵向研究。
在本应用说明中,两种不同的细胞系用Cellaris™荧光纳米颗粒(Luminicell)标记,然后接种在2孔插件共聚焦皿中(ibidi,81176)进行2D侵袭实验。移除2孔插件(Culture-Insert 2 Well)后,荧光标记有助于区分两种细胞群体的迁移行为。
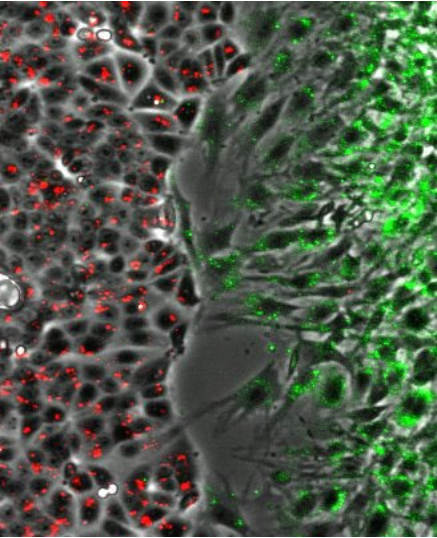
在ibidi 2孔插件共聚焦皿中生长的MCF-7细胞(Cellaris™ 670.红色)和NIH-3T3细胞(Cellaris™ 540.绿色)的共培养
ibidi双细胞共培养侵袭实验新方案
1 材料
1.1 试剂和缓冲液
Cellaris™ 540 - 细胞标记试剂盒(绿色)和Cellaris™ 670 - 细胞标记试剂盒(红色),(Luminicell)
MCF-7细胞系(乳腺癌,人)和NIH-3T3细胞系(成纤维细胞,小鼠)
细胞培养基:RPMI-1640(Gibco,21845034),补充10%胎牛血清(Gibco;10270106)
标准细胞培养试剂(PBS、胰蛋白酶/EDTA)
1.2 设备
• 预置2孔插件的共聚焦皿(Culture-Insert 2 Well in µ-Dish 35 mm)(ibidi,81176)
• 标准细胞培养设备(无菌工作台、细胞培养箱、培养瓶、移液器、抢头等)
• 镊子
• 配备FITC和Cy5 HC滤光片组(Nikon)的Nikon TI显微镜、4x CFI PlanFluor DL物镜(Nikon)、LED Sola Light Engine (lumencor)、ORCA-Flash 4.0-LT相机(Hamamatsu Photonics)
• ibidi载物台培养箱载玻片/培养皿,CO2/O2–银色系列(Stage Top Incubator Slide/Dish, CO2/O2–Silver Line(ibidi,12722))

2 准备
2.1 使用Cellaris™细胞标记试剂盒标记细胞
• 在T25细胞培养瓶(或其他细胞培养实验室器皿)中培养细胞至80-90%汇合。
• 通过将Cellaris™纳米颗粒在5ml补充细胞培养基中稀释至2nM(100倍),分别制备染色溶液。
• 用制备好的染色溶液替换细胞培养瓶中的旧培养基,并在细胞培养箱中孵育1-24小时,具体时间根据细胞类型而定。此处,我们将MCF-7细胞用Cellaris™ 670染色,将NIH-3T3细胞用Cellaris™ 540 染色,持续2-4小时。
2.2 在Culture-Insert 2 Well中设置伤口愈合实验
• 染色后,按常规方法收集细胞。包括离心步骤以去除细胞碎片和游离纳米颗粒。
• 根据细胞类型,准备3-7×105个细胞/ml的细胞悬液。对于MCF-7和NIH-3T3.使用3×105个细胞/ml的细胞浓度,可在24小时内形成汇合的细胞层。
• 在无菌工作台中取出带有Culture-Insert 2 Well的µ-Dish。
• 在一个孔中加入70µl MCF-7悬液,在Culture-Insert的第二个孔中加入70µl NIH-3T3悬液。让细胞沉降5-10分钟,避免摇晃,因为这会导致细胞分布不均匀。
• 将带有Culture Insert的µ-Dish放入湿润的腔室(例如,带有湿纸巾的培养皿)中,然后放入细胞培养箱中。在37°C和5%CO2下孵育24小时或直到细胞层汇合。
• 将µ-Dish放入无菌工作台上,用无菌镊子夹住Culture-Insert 2 Well的一角,轻轻移除Culture-Insert 2 Well。
• 向µ-Dish中加入2 ml补充的细胞培养基。如有必要,可进行洗涤步骤以去除未贴壁细胞或细胞碎片。
• 用盖子盖住µ-Dish。此时,样品已准备就绪,可进行镜检成像。
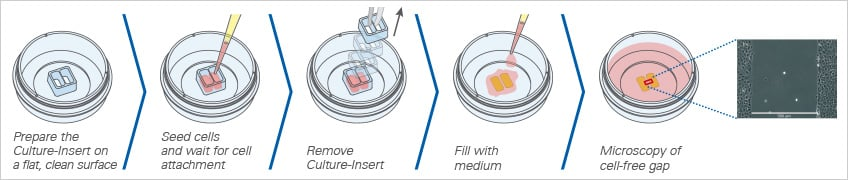
图1.Culture-Insert 2 Well实验流程
2.3 活细胞荧光显微成像
• 提前预热显微镜的孵育系统(如ibidi Stage Top Incubator)(在实验前至少0.5-2小时)。在37°C、5%CO2和80%湿度下进行实验。
• 将样品放置在显微镜载物台上的孵育腔内,并使用4倍物镜聚焦细胞层。
• 实验设置:每20分钟采集一次伤口区域的相差、FITC(Cellaris™ 540)和Cy5(Cellaris™ 670)通道图像。确保在图像采集间隔期间关闭照明光源。
1)Cellaris™ 540可用紫/蓝光源激发(Ex 423nm,Em 540nm)。
2)Cellaris™ 670可用蓝/绿光源激发(Ex 506nm,Em 670nm)。
重要提示:为减少光照对细胞造成的应激,建议降低激发光源的照明强度,例如在中性密度滤光片(ND4. ND8)插入光路中。
• 监测细胞行为24-72小时。使用合适的图像分析软件(例如ImageJ(NIH))处理和评估延时图像。
3 结果
染色过程有效地将纳米颗粒整合到细胞中,而对细胞活力没有明显的adverse effects(不良影响).Cellaris™为延时显微镜提供了清晰且可区分的荧光信号。Culture-Insert 2 Well能够创建一个清晰的划痕间隙,从而可以精确追踪两种单独标记的细胞群体的细胞迁移和行为随时间的变化,如图2所示。在活细胞成像条件下实时观察细胞运动,可为划痕愈合的动态提供有价值的见解,这在图2中清晰可见。
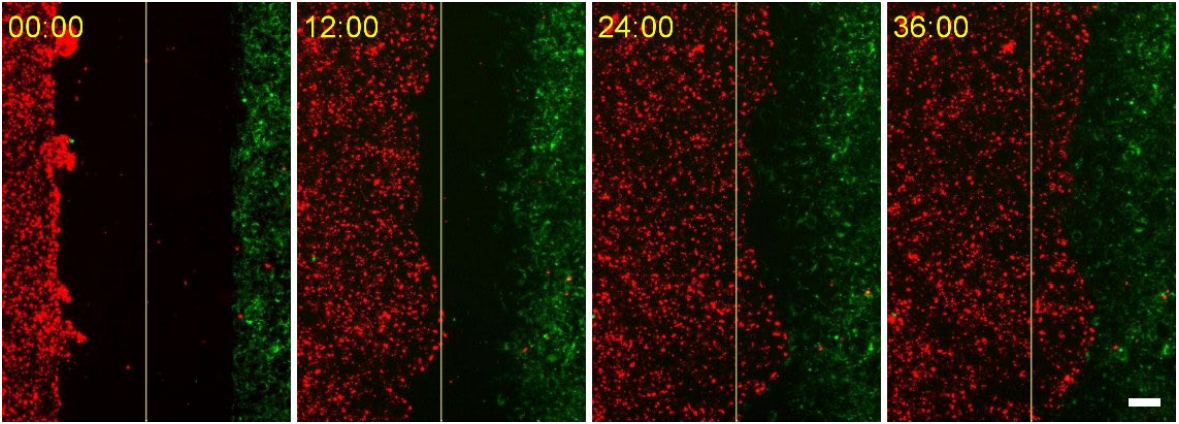
图2.MCF-7细胞(Cellaris™ 670.红色)和NIH-3T3细胞(Cellaris™ 540.绿色)的延时图像显示了各自细胞系的迁移以及初始500µm宽的划痕间隙的闭合。黄线标记间隙的中线。MCF-7细胞迁移得更快,并在36小时内闭合了间隙。比例尺= 100µm
相差和荧光成像的结合能够可视化标记的均匀性。图3显示,颗粒不仅在一个细胞内是均匀的,而且在整个细胞层上也是均匀的。此外,正如白色箭头所指示的那样,当两个细胞前沿融合时,似乎没有两个细胞之间的交叉标记。这一证据表明,即使在长期活细胞研究中,Cellaris™在多色实验中也不会表现出串扰效应。
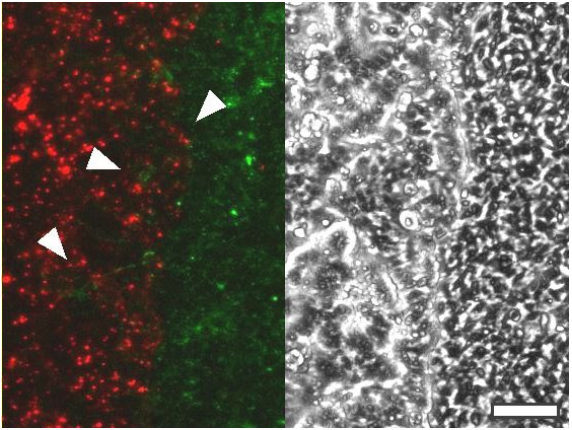
图3.在实验开始90小时后拍摄的MCF-7(Cellaris™ 670.红色)和NIH-3T3(Cellaris™ 540.绿色)融合图像的细节图。左侧图像中箭头显示细胞侵入另一个群体。右侧图像显示相同区域的相差图像。比例尺=100µm
本研究旨在探索使用一种简单但有效的标记方法进行共培养和迁移研究。使用Cellaris™细胞标记试剂盒成功标记了MCF-7和NIH-3T3细胞,随后将其用于与Culture-Insert 2 Well划痕插件进行的细胞侵袭划痕实验。Cellaris™细胞标记试剂盒和Culture-Insert 2 Well划痕插件的易用性,使得实验操作简便,并能获得可靠且可重现的结果。

ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.