date:2019-03-02 13:55:07

细胞迁移发生在很多重要的生理过程中。比如,胚胎发育,组织损伤和伤口愈合的过程中细胞的迁移就是受到调控的。相反,细胞迁移在许多病理情况比如癌症转移和炎症下是失调的。不足为奇,许多细胞迁移的原理已经在很多情况下研究过了。
1. 伤口愈合和迁移实验的应用
伤口愈合和迁移实验是广泛用于不同条件下分析细胞迁移的方法。
他们有助于理解下面相关的科学问题。
1 不同条件下迁移和伤口愈合研究:
细胞如何在不同条件下迁移(比如,被特定的化合物/增强剂/抑制剂处理后,SiRNA或者CRISPR/Cas9基因沉默后,底物硬度改变后,或者基质组成改变后)
2 高通量药物筛选:
哪一种药物可以改变特定细胞的迁移速率(比如,癌细胞)
3 细胞相互作用研究:
细胞是保持相互接触,还是异常迁移。迁移过程中细胞是如何相互作用的。 细胞自主性的迁移能力如何?
4 2D侵袭实验:
两种不同类型细胞如何相互作用(比如肿瘤细胞和成纤维细胞)
和一般的伤口愈合和迁移不同,定向迁移实验,比如细胞趋化实验,测定在2D或者3D环境下浓度梯度依赖的细胞运动。
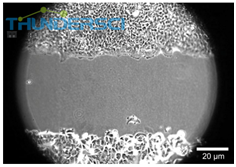
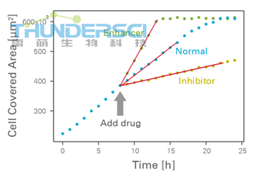
2D侵袭实验中两种不同类型的细胞 抑制剂或增强剂对伤口愈合影响的示例
2. 如何做一个伤口愈合和迁移实验
典型的伤口愈合和迁移实验的结果就是随着时间的变化细胞覆盖面积(伤口闭合)的变化。
进行伤口愈合和迁移实验是一个非常简单的操作。
1 在细胞单层间制造出一个物理伤口。
2 在不同时间点进行拍照,或者进行实时成像观察细胞迁移到伤口的过程。
3 采用手动或者自动化软件分析伤口闭合的速率,这就是典型的实验结果。
尽管伤口愈合实验很简单,但是许多因素会影响到实验结果。因此要控制好这些因素。
下面我们讨论一下伤口愈合的实验设置和原理。此外,我们还要讨论一些需要标准化的参数,从而获得可重复,稳定的结果。

MCF7细胞伤口形成后伤口闭合的活细胞成像图
伤口愈合实验流程图

开始实验之前需要回答以下问题:
1 能否重复细胞培养条件?
由于许多外部因子可能影响到伤口愈合实验的结果,这就需要事先开发出一个标准的方法学。
整个实验过程中的步骤需要保持一致。如果可以,每一次实验所用到的设备,细胞代数,培养液替换次数,试剂和耗材都应当一样。
2 应该用哪一种细胞培养器皿?
细胞培养器皿需要有一个薄底(-170μm),这样对于高分辨率活细胞成像和倒置显微镜是出色的。(比如,ibidi多聚物玻片)培养器皿的大小需要便于伤口的形成。根据样本数量,ibidi有μ培养皿(35mm高壁)的培养插件或者μ-24孔培养板可以选择使用。如果不需要高分辨率荧光显微镜成像,培养插件也可以自己插入到各种规格的培养器皿里,比如培养皿,细胞培养小室,多孔板。
3 应该使用哪种基底?
哪种基底取决于细胞类型和实验条件。组织处理的基底可以给细胞提供足够的吸附。
就像ibidi多聚物玻片,适用于大多数细胞类型。然而有些细胞类型需要一些特殊的包被。
关于详细的如何自己包被μ玻片和μ培养皿可以查看ibidi细胞包被的应用指南。
4 需不需要抑制细胞增殖?
在伤口愈合实验中,细胞不仅仅会迁移到伤口处,而且也会增殖。在形成伤口前,可以使用增殖抑制剂比如mitomycin 或者 actinomycin C处理细胞来抑制增殖。但是需要事先确定好剂量和相应的对照,这样细胞不会因为生长抑制的药物而造成细胞凋亡或者改变了迁移能力。
5 理想的细胞密度是多少?
理想状态下,伤口愈合实验应该是在显微镜下观察到细胞单层长满后立即进行。细胞接种密度需要根据不同细胞类型来分别确定。出色的状态就是细胞在接种24小时形成单细胞层。
6 如何形成伤口?
生成的伤口的一致性对于伤口愈合实验是其重要。目前有几种在单层细胞形成伤口的方法:用针或者枪头划,放入一个插件或者膜具,化学表面处理,或者用电处理等,不同方法各有优缺点。
7 伤口闭合如何监测?
在不同时间点进行拍照观察伤口闭合是可以的。但是对于绝大多数实验设计来讲,活细胞成像是精确,也是很方便地监测伤口闭合的。
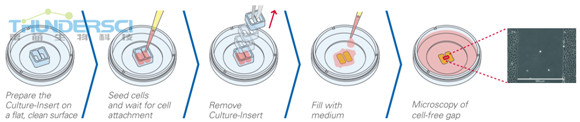
3. 伤口愈合实验流程:
1样本制备
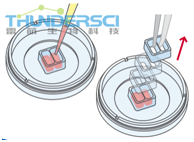
步骤:使用Ibidi培养插件形成的伤口,由于无细胞伤口的大小固定,这就确保了高度可重复性。
在合适的培养器皿里面选择恰当的培养插件。接种培养细胞到显微镜下长满,形成单层。让细胞生长大约24小时,如果有必要,可以用增殖抑制剂处理细胞,然后移除培养插件形成伤口。
Ibidi的解决方法:
Ibidi培养插件2孔,3孔,四孔是特定大小细胞伤口的硅胶插件,用于伤口愈合,迁移,2D侵袭实验,细胞共培养。
他们有预装在μ35mm培养皿中的独立插件,也有25个整体放在运输培养皿中自己手动插入的。
它提供了一种快捷便利的实验方法。
培养插件两孔24是预装在24孔板里面的,是非常划算的,可以直接用于高通量实验。
Ibidiμ两孔载玻片的两个孔的大小刚好可以插入培养插件。
2 活细胞成像

步骤:绝大多数情况下,伤口形成后立即使用相差显微镜监测细胞的状况。既可以在不同时间点(比如6和12小时后)拍摄伤口照片,也可以进行活细胞成像。通常监测细胞24小时左右就足够了。想要精确地分析,那么整个实验过程中就需要观察伤口的同一个位置。
Ibidi的解决方法:
Ibidi加热和气体孵育系统在显微镜下提供了一个生理环境。使得在伤口愈合和迁移实验过程中可以进行活细胞成像。
3 数据分析
步骤:一个典型的伤口愈合或者迁移实验生成GB数量的图像数据,需要通过手动图像分或者自动化软件析进一步处理。众多的实验方法中,主要的结果就是伤口闭合的速度。其他结果可能包括无细胞区域和细胞覆盖区域的测定。
Ibidi的解决方法:
使用伤口愈合ACAS图像分析软件,ibidi提供了一种省时全自动化定量分析伤口愈合和迁移实验的方法。
它包括分析无细胞区域,细胞覆盖区域以及伤口闭合速度。
4. 使用不同方法在细胞单层制造伤口:
1 插入:接种细胞前,在培养表面置入插件/模块来物理性排除细胞。
2 划痕:在表面划痕(划痕实验)机械去除细胞。
3 阻抗:在特定区域内用电压去除细胞。
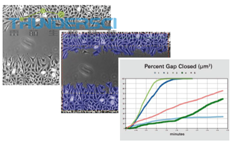
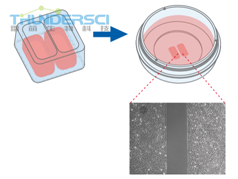
Ibidi提供了三种不同的培养插件用于形成伤口:ibidi培养插件2孔,3孔以及4孔。
由于特殊设计的底部,培养插件黏附在表面,阻碍了壁下任何细胞的生长。移除培养插件后,新形成的无细胞伤口处没有任何残留。这种方法可以重复地形成高度一致的没有任何细胞的伤口
当放置在平整,干净的表面,培养插件2孔给培养的细胞提供了两个储液池,中间被500μm厚度的壁给分隔开。细胞接种在储液池中培养,一直到他们贴壁,形成单细胞层。移除表面的硅胶插件后会形成两个精确大小的细胞斑块,由一个大小和分割壁一样宽度的区域所分开。接着就可以通过活细胞成像或者在不同时间点拍照来监测细胞迁移。
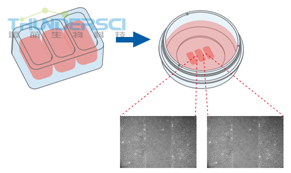
培养插件3孔提供了三个细胞储液池。它可以形成两个无细胞伤口,每个500μm. 因而适用于分析两个技术重复样本或者不同细胞类型的迁移。
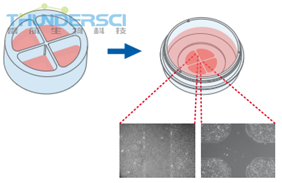
培养插件4孔提供四个细胞培养储液池。除了四个500μm的无细胞区域外,还包括一个1mm的中间伤口区域。培养插件4孔可以观察四个技术重复样本或者不同细胞类型的迁移。

培养插件3孔/4孔都可以在药物处理或者基因沉默/过表达(比如通过CRISPR/Cas9, SiRNA, mRNA)
后进行细胞迁的分析。重要的是,未处理的对照组可以在同一个培养器皿里面接种,分析,共享同样的培养液。
和其他伤口形成技术不同,ibidi的培养插件适合2D侵袭实验和共培养实验,同时可以实验
两种,三种甚至四种细胞类型或者处理方式。
5. ibidi培养插件部分客户发表文章:
Inhibition of Tunneling Nanotube (TNT) Formation and Human T-cell Leukemia Virus Type 1 (HTLV-1) Transmission by Cytarabine.
Scientific Reports, 2018, 10.1038/s41598-018-29391-w
Stapled peptide inhibitors of RAB25 target context-specific phenotypes in cancer.
Nature Communications, 2017, 10.1038/s41467-017-00888-8
Endothelial Notch signalling limits angiogenesis via control of artery formation.
Nature Cell Biology, 2017, 10.1038/ncb3574
EphA2 Drives the Segregation of Ras-Transformed Epithelial Cells from Normal Neighbors.
Current Biology, 2016, http://dx.doi.org/10.1016/j.cub.2016.09.037
A molecular mechanotransduction pathway regulates collective migration of epithelial cells.
Nat Cell Biol, 2015, 10.1038/ncb3115
Control of ground-state pluripotency by allelic regulation of Nanog
Nature, 2012, 10.1038/nature10807
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.