date:2023-07-27 14:15:22
内皮细胞(ECs)是排列在血管内表面的特化细胞,形成连续的单细胞层。因此,它们是血管壁的一部分,在控制血流和周围组织之间的物质交换中起着至关重要的作用[1]。内皮细胞根据其在循环系统中的位置进一步细分,如动脉、静脉、毛细血管和淋巴管。在这篇文章中,我们将探讨内皮细胞的功能,重点是心血管系统的内皮细胞。具体而言,我们将研究如何在体外研究内皮细胞在血管生成、屏障形成、血流不足和炎症方面的作用。
基础情况
血管生成是新血管生长的过程。因此,它在发育生物学、伤口愈合以及肿瘤生长中起作用(图1)。血管生成本身由多个步骤组成,包括:
*EC增殖
*定向迁移(通常通过趋化性)
*管道形成和管腔化
*成熟:成熟、融合、重塑、次级细胞的募集(如周细胞和血管平滑肌细胞)
总之,这些步骤共同促进了整个血管生成过程,即从现有血管形成新血管[2]。毫无疑问,血管生成是高度复杂的。要全面了解整个过程,我们需要检查各个组成部分。采用体外分析使科学家能够专注于血管生成过程的特定成分,从而促进更可控和详细的分析。
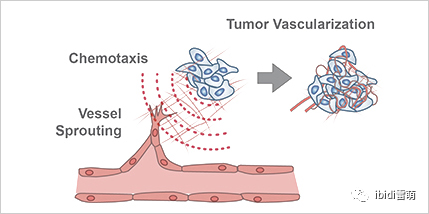
图1.研究血管生成过程,如血管发芽和趋化性,对于理解肿瘤血管形成至关重要
应用实例1:阐明间隙连接在内皮细胞迁移中的作用
Mannell等人2021年的这项研究检测了间隙连接蛋白43(Cx43)在EC迁移和血管生成中的作用。该研究小组发现,在人微血管内皮细胞(HMEC)中,siRNA敲低Cx43可减少细胞迁移(图2)。从机制上讲,研究小组发现Cx43的功能是通过与酪氨酸磷酸酶SHP-2[3]相互作用介导的。
为了研究CX43在EC迁移中的作用,如先前研究所述,将 ibidi Culture-Inserts插件放置在 µ-Slide 8Well(8孔腔室载玻片)中,以评估迁移速度和方向性[3]。
该小组表明:内皮细胞迁移和血管生成需要Cx43,而这是由SHP-2介导的。
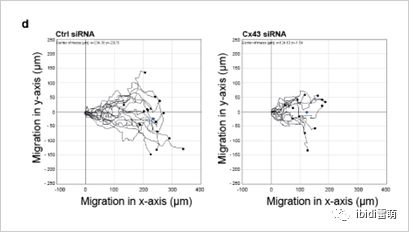
图2.HMEC迁移单细胞轨迹显示Cx43 siRNA敲除后迁移减少。图片来自Mannell等人2021[3]
ECs in Barrier Formation屏障形成中的内皮细胞
血管中的内皮细胞单细胞层对其在血液和周围组织之间形成屏障的功能至关重要,最著名的是血脑屏障(BBB)。内皮细胞通过多种途径积极调节化合物转运,包括细胞旁水性途径、跨细胞亲脂性途径、受体介导的跨细胞转运、载体介导的内流和吸附性跨细胞转运(图3)
由于其在药物递送、药理学、毒理学和肿瘤学中的重要性,了解EC屏障的功能和机制是一个备受研究的研究领域。
了解EC屏障的功能和机制是一个备受研究的研究领域,因为它在药物传递、药理学、毒理学和肿瘤学中具有重要意义。
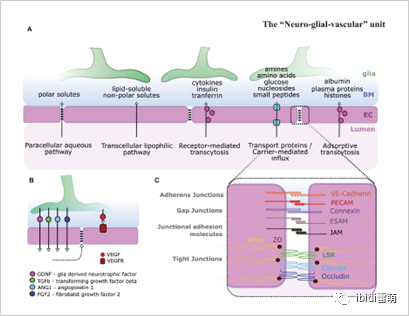
图3.ECs(品红色)在屏障形成中起着关键作用。图片来自Kugler等人,2021[5]
应用实例2:血脑屏障体外模型的建立

在Choublier等人在2021年[6]进行的一项研究中,解决了与研究血脑屏障相关的实验挑战。血脑屏障由于其在大脑中的位置以及对恒定、层流和均匀血流的需求而存在困难。为了应对这些挑战,研究人员开发了一种坚固、低成本的装置,将上部通道连接到 ibidi Pump System ibidi泵系统/流体剪切力系统,建立四天的培养基单向循环以模拟生理条件。
Choublier及其同事表明,该装置适用于评估屏障功能(图4)和研究药物通过血脑屏障的转运。此外,ibidi泵系统和µ-Slide具有评估和复制在人体细胞类型(如肠道或肾脏)中发现的屏障的潜力。
建立一个具有调节流动的系统可以在类似体内的条件下研究内皮细胞,这比静态系统更好地模拟真实的生理状态。
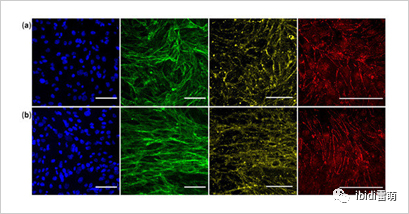
图4.在静态条件下(a)和静态流动下(b)培养7天的细胞,显示内皮单层特化。蓝色细胞核、绿色F-肌动蛋白、黄色β-连环蛋白粘附连接和红色ZO-1紧密连接。图片来自Choublier等人,2021[6]
流动中的内皮细胞
血流产生的剪应力对EC细胞极化、蛋白质表达和形态学有直接影响(图5)。虽然一个主要的研究领域是了解静态流动导致生理EC,但另一个研究领域是研究紊乱的流动状态如何导致动脉粥样硬化等疾病。
图5.血流产生的剪切应力直接影响细胞极化、蛋白质表达和形态
应用实例3:解读线粒体在内皮细胞健康中的作用

Hong等人2022[7]的这项工作,研究了了线粒体在维持内皮细胞稳态和健康中的作用。研究结果表明,线粒体断裂在暴露于紊乱流动的区域增加,而细长的线粒体在单向流动的区域占主导地位。这表明流动模式对线粒体融合/分裂事件有深远的影响,影响内皮细胞的促炎和代谢状态。研究人员使用了 ibidi Pump System ibidi泵系统/流体剪切力系统来研究流动模式相关的动力学。
总之,这项研究表明,流动对内皮细胞的健康有着至关重要的影响,这在一定程度上是由于线粒体的变化。
炎症中的内皮细胞
全身炎症对内皮细胞以及内皮细胞如何与其他细胞相互作用有直接影响。一般来说,由内皮细胞形成的屏障会变得更容易泄漏[8],并且诸如免疫细胞滚动,趋药性和跨内皮迁移在炎症期间升高(图6)。
图6.炎症过程影响内皮细胞,以及内皮细胞如何与其他细胞相互作用。例如,诸如免疫细胞滚动、趋化性和跨内皮迁移等过程在炎症期间升高。
应用实例4:研究导致动脉粥样硬化的因素
在Forde等人2020[9]的一项研究中,研究了促动脉粥样硬化条件下肿瘤坏死因子相关凋亡诱导配体(TRAIL)对人主动脉内皮细胞(HAEC)的影响。结果表明,在暴露于振荡剪切应力的HAEC中,TRAIL使基因表达向抗氧化方向转变,从而具有血管保护作用。此外,TRAIL显著减少了暴露于TNF-α和高血糖的HAEC中活性氧(ROS)的形成。这些发现表明TRAIL通过减少氧化应激对内皮细胞具有动脉粥样硬化保护作用。
本研究使用 ibidi Pump System ibidi泵系统/流体剪切力系统和 ibidi Channel Slide通道玻片建立了最先进的促动脉粥样硬化振荡剪切应力培养模型,已知振荡剪切应力可促进动脉粥样硬化的形成[10]。
在这篇文章中,我们探讨了心血管系统中的内皮细胞以及体外研究内皮细胞的意义。我们旨在了解内皮细胞在不同生理环境中的作用,这使我们能够认识到,不仅内皮细胞的规格和状态很重要,而且它们的环境也很重要。
通过在受控条件下进行研究,体外研究为单独通过体内实验探索具有挑战性或不可能的过程提供了有价值的见解。通过研究各种机制和过程,如血管生成、屏障形成、血流不足和炎症,我们强调了体外研究的价值。
参考文献
[1]Krüger-Genge A,Blocki A,Franke RP,Jung F.Vascular Endothelial Cell Biology:An Update.Int J Mol Sci.2019 Sep 7;20(18):4411.doi:10.3390/ijms20184411.
[2]Adair TH,Montani JP.Angiogenesis.San Rafael(CA):Morgan&Claypool Life Sciences;2010.Chapter 1,Overview of Angiogenesis.
[3]Mannell H,Kameritsch P,Beck H,Pfeifer A,Pohl U,Pogoda K.Cx43 Promotes Endothelial Cell Migration and Angiogenesis via the Tyrosine Phosphatase SHP-2.Int J Mol Sci.2021 Dec 28;23(1):294.doi:10.3390/ijms23010294.
[4]Kameritsch P,Kiemer F,Mannell H,Beck H,Pohl U,Pogoda K.PKA negatively modulates the migration enhancing effect of Connexin 43.Biochim Biophys Acta Mol Cell Res.2019 May;1866(5):828-838.doi:10.1016/j.bbamcr.2019.02.001.
[5]Kugler EC,Greenwood J,MacDonald RB.The"Neuro-Glial-Vascular"Unit:The Role of Glia in Neurovascular Unit Formation and Dysfunction.Front Cell Dev Biol.2021 Sep 27;9:732820.doi:10.3389/fcell.2021.732820.
[6]Choublier N,Müller Y,Gomez Baisac L,Laedermann J,de Rham C,Declèves X,Roux A.Blood–Brain Barrier Dynamic Device with Uniform Shear Stress Distribution for Microscopy and Permeability Measurements.Appl.Sci.2021 Nov;11(12):5584.doi.org/10.3390/app11125584
[7]Hong SG,Shin J,Choi SY,Powers JC,Meister BM,Sayoc J,Son JS,Tierney R,Recchia FA,Brown MD,Yang X,Park JY.Flow pattern-dependent mitochondrial dynamics regulates the metabolic profile and inflammatory state of endothelial cells.JCI Insight.2022 Sep 22;7(18):e159286.doi:10.1172/jci.insight.159286.
[8]Obermeier B,Daneman R,Ransohoff RM.Development,maintenance and disruption of the blood-brain barrier.Nat Med.2013 Dec;19(12):1584-96.doi:10.1038/nm.3407.
[9]Forde H,Harper E,Rochfort KD,Wallace RG,Davenport C,Smith D,Cummins PM.TRAIL inhibits oxidative stress in human aortic endothelial cells exposed to pro-inflammatory stimuli.Physiol Rep.2020 Oct;8(20):e14612.doi:10.14814/phy2.14612.
[10]Davies PF.Hemodynamic shear stress and the endothelium in cardiovascular pathophysiology.Nat Clin Pract Cardiovasc Med.2009 Jan;6(1):16-26.doi:10.1038/ncpcardio1397.
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.