date:2023-08-10 09:23:29
ibidi完成了对在免疫学研究领域做出杰出贡献的的早期职业科学家的搜寻。前三名候选人现已由外部评审团选出,并将因其在该领域的贡献而授予2023年ibidi论文奖,每人将获得500欧元的奖金。
在此恭贺获奖者!
感谢您提交您的论文,并使2023年ibidi论文奖取得巨大的成功。
特别感谢外部评审团成员Dr. Tim Lämmermann, Prof. Dr. Christian Münz, 和 Prof. Dr. Michael Dustin,在获奖者评选过程中给与的支持。

Max Grö nloh在EMBO Reports中以第一作者身份发表的论文:
内皮迁移热点通过ICAM-1的异源表达限制血管渗漏

Max Grönloh, M.Sc.理学硕士
Max是一名细胞生物学家,专门从事免疫学和内皮生物学领域的研究。他在阿姆斯特丹大学获得了学士和硕士学位(以优异成绩),专注于使用先进的显微镜技术来回答细胞生物学的问题。在他的第一个硕士实习期间,他开发了一种新的MAP激酶生物传感器,并利用它们研究了钙感应受体下游反应的细胞异质性。在他的第二次实习中,他使用超分辨率显微镜研究运动蛋白Myosin10在丝状足尖端的整合素活化。目前,Max正处于博士研究的最后一年,正在研究白细胞外渗。他主要致力于弄清楚哪些因素决定了白细胞会在脉管系统中特定的非随机点渗出的原因。除了他的博士工作,他对细胞迁移,细胞骨架功能和显微镜的最新发展充满热情。他现在正在寻找博士毕业后的机会。
为什么Max Grö nloh的这篇论文能折服陪审团:
Grönloh 等人发现内皮迁移热点限制炎症引起的外渗期间的血管渗漏。这些热点是炎症期间白细胞穿过内皮单层的区域。细胞间粘附分子-1ICAM-1)的异质分布决定了迁移热点的位置,而ICAM-1异质性的丧失会导致迁移热点的丧失,但不一定会减少跨内皮迁移(TEM)事件。内皮热点的丧失导致 TEM期间血管渗漏增加。
这项全面的研究为一些 ICAM-1靶向疗法具有复杂的效果提供了宝贵的见解,因为它们甚至可能增加与血管渗漏相关的炎症,而他们也希望通过治疗来减少这种情况。
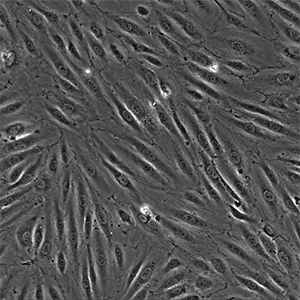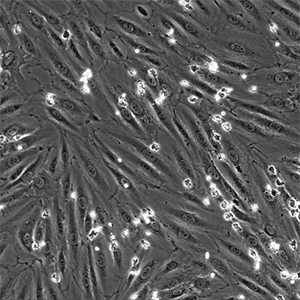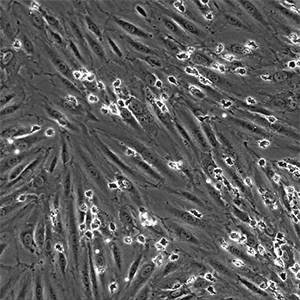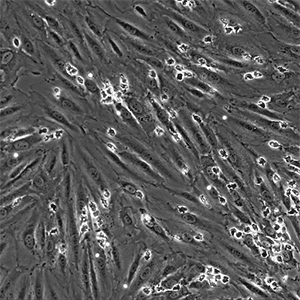
![]()
图片:μ-Slide VI 0.4用于在生理流动条件下将分离的原代人中性粒细胞灌注到 TNFa 发炎的 HUVEC 上。视频:中性粒细胞通过单层内皮细胞迁移。中性粒细胞似乎以非随机方式彼此靠近地迁移,称为迁移热点。
Grönloh MLB, Arts JJG, Palacios Martínez S, van der Veen AA, Kempers L, van Steen ACI, Roelofs JJTH, Nolte MA, Goedhart J, van Buul JD. Endothelial transmigration hotspots limit vascular leakage through heterogeneous expression of ICAM-1. EMBO Rep. 2023 Jan 9;24(1):e55483. doi: 10.15252/embr.202255483.
Luise在BRAIN中以第一作者身份发表的论文:
抗泛神经束蛋白抗体诱导亚类相关补体激活和结旁损伤

路易斯·阿佩尔特肖泽,医学博士,理科硕士
Luise 是德国维尔茨堡大学医院的神经内科住院医师和博士后研究员。她在维尔茨堡大学 Claudia Sommer 教授和 Kathrin Doppler 博士的小组中以“优异成绩”完成了医学博士论文,在那里她发现了自身免疫性神经病中的新自身抗原。此外,她还在维尔茨堡大学获得了实验医学硕士学位。作为一名临床科学家,她从那时起一直致力于抗体介导的神经系统疾病的临床概况和病理生理学研究。她在实验室建立了新的细胞培养模型、成像技术和诊断阵列,这有助于她识别和研究自身免疫性神经病的新靶抗原。她在高影响力的科学期刊上发表文章,荣获多项奖项,并获得了大学的不同研究奖学金。Luise对从实验室到临床的研究非常着迷,她希望她的研究能够直接改善患有严重自身免疫性神经系统疾病的患者的治疗和生活质量。
为什么Luise Appeltshauser的这篇论文能折服陪审团:
抗泛神经成束蛋白抗体与结节性副狂病的新亚型相关,这是相关的,因为它与高发病率和死亡率相关。致病性,包括 IgG 亚类相关机制,尚未阐明,也未直接与抗神经成束蛋白 155 IgG4 相关病理学进行比较。在本出版物中,Appeltshauser等人。研究了泛神经成束蛋白抗体相关的结节性副病,检测了 IgG3 亚类并将其与体外补体结合和细胞毒性作用相关联。
在这项研究中,作者成功地对结节性偏执病子集的假定致病抗体进行了功能表征。他们使用优雅的细胞培养系统研究了这些泛神经成束蛋白特异性 IgG3 抗体的 Fc 介导和 Fc 独立机制。
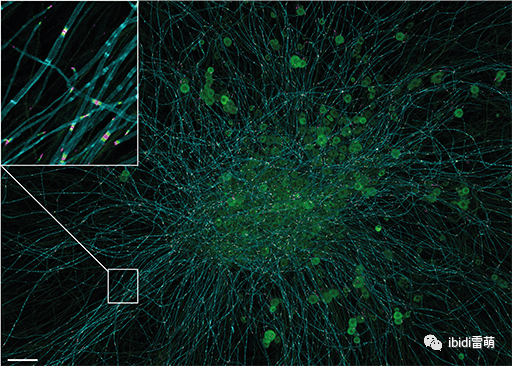
培养 21 天后的小鼠背根神经节外植体的共聚焦图像,对髓磷脂标记物(髓磷脂相关糖蛋白,青色)和结节旁标记物泛神经成束蛋白(洋红色)和 Caspr-1(绿色)进行三重免疫染色。髓鞘共培养模型实现了成熟的 Ranvier 节点和致密髓鞘(入口),可用于研究髓鞘形成、Ranvier 节点发育以及多发性神经病患者的人类自身抗体的致病作用。比例尺 = 100μm。
Appeltshauser L,Junghof H,Messinger J,克林J,Haarmann A,Ayzenberg I,Baka P,Dorst J,Fisse AL,Grüter T,Hauschildt V,rk A,Leypoldt F,Mä urer M,Meinl E,Michels,Motte J,Pitarokoili K,Stettner M,Villmann C,Weihrauch M,Welte GS,Zerr I,Heinze KG,Sommer C,Doppler K .抗泛神经束蛋白抗体诱导大脑。2023年5月2日;146(5):1932-1949.doi: 10.1093/brain/awac418。
Nicklas Schmacke在《免疫》杂志中以第一作者身份发表的论文:
IKKb通过将NLRP3募集到跨高尔基体网络来启动炎症小体的形成

尼克拉斯·施马克,理学硕士
Niklas在德国波恩大学获得学士和硕士学位。他于2017年以博士生身份加入慕尼黑基因中心Veit Hornung实验室。Niklas的研究重点是了解免疫系统如何检测病原体和其他非自身实体。在实验室期间,Niklas发现了NLRP3炎性体的一种新启动方式,这是一种细胞死亡和炎症诱导蛋白复合物,在多种促炎环境中发挥着关键作用,包括感染和阿尔茨海默病。此外,他还开发了一种使用先进显微镜对基于图像的细胞表型进行全基因组筛选的技术。目前,Niklas正在与Fabian Theis 和Veit Hornung合作,利用深度学习对单细胞图像中的表型进行无偏识别。
为什么 Niklas Schmacke的这篇论文能折服陪审团:
NLRP3 炎性体是先天免疫反应的关键激活途径,也是哺乳动物抗菌防御的核心。在炎症小体完全激活之前,需要初始启动信号。Schmacke等人令人惊讶的发现是,与小鼠巨噬细胞相比,人类巨噬细胞使用另一种默认途径来启动 NLRP3。虽然小鼠细胞主要依赖 NEK7 来启动反应,但人类骨髓细胞却绕过 NEK7,而是默认使用以前未被重视的 IKKβ 依赖性途径来启动 NLRP3。这些新发现提高了我们对人类炎症体调节的理解,这与人类疾病和潜在的治疗干预措施相关。
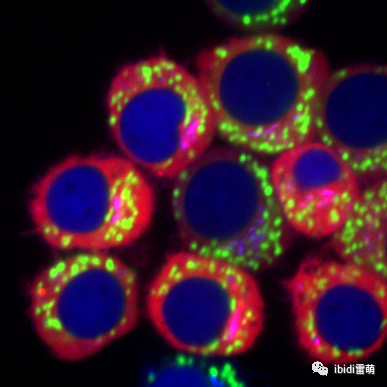
J774 小鼠巨噬细胞表达荧光蛋白和炎症小体传感器 NLRP3(红色)以及跨高尔基体网络标记(蓝色)的融合体。用促炎细菌成分 LPS 刺激细胞,并对线粒体进行染色(绿色)。该图像是在转盘共聚焦显微镜上以 100 倍放大倍数从活细胞中拍摄的。
Schmacke NA,O'Duill F,Gaidt MM,Szymanska I,Kamper JM,Schmid-Burgk JL,Mä dler SC,Mackens-Kiani T,Kozaki T,Chauhan D,Nagl D,Stafford CA,Harz H,Frö hlich AL,Pinci F,Ginhoux F,Beckmann R,Mann M,莱恩哈特H,Hornung V. IKKβ primes通过将NLRP3招募到跨高尔基体网络形成炎性小体。豁免权。2022年12月13日;55(12):2271-2284 . E7 . doi:10.1016/j . immuni . 2022 . 10 . 021
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.