date:2023-12-21 16:11:49
实验实例:
3D矩阵中的单细胞
* HT-1080癌细胞在胶原基质球体和类器官培养中迁移的3D活细胞成像
球体和类器官培养
* 在确定的微图案上形成球体
* 当在灌注下培养时,球体生长率大大提高
* 长期培养球体的活/死染色
* PDAC细胞和成纤维细胞的类器官共培养
* HT-1080癌细胞在3D胶原凝胶中的侵袭
* 内皮细胞在3D胶原凝胶中的发芽
* L929球体横截面的共聚焦显微镜成像
3D中的趋化性和迁移分析
* 3D中I型胶原蛋白凝胶内皮细胞向FCS梯度的趋化性
3D矩阵中的单细胞
HT-1080癌细胞在胶原基质球体和类器官培养中迁移的3D活细胞成像
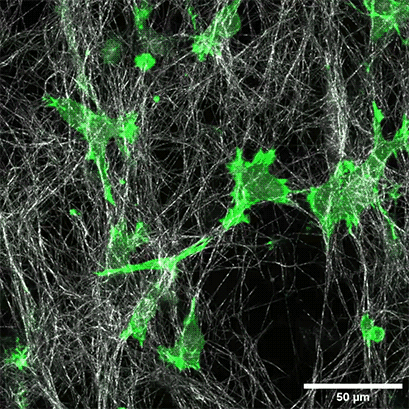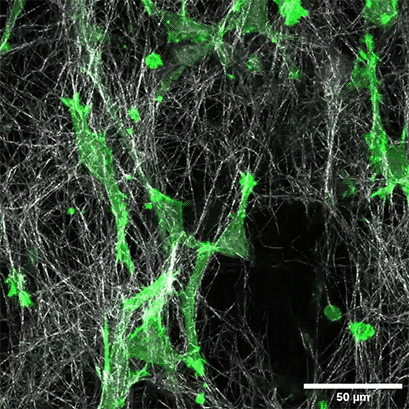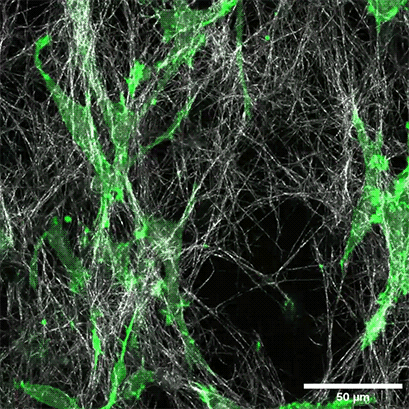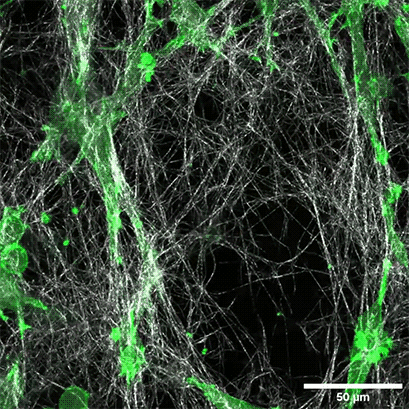
将表达LifeAct的HT-1080细胞(绿色)接种在1.5毫克/毫升I型胶原蛋白,大鼠尾层(白色)的µ-Slide Chemotaxis细胞趋化载玻片中。通过使用水浸物镜40x/1.2在蔡司共焦显微镜LSM 880 AxioObserver上每300秒拍摄一张照片来记录细胞迁移。
球体和类器官培养
在确定的微图案上形成球体
微图案是优化3D分析的强大工具。ibidi的µ-Slides With Multi-Cell µ-Patterns载玻片能够为各种2D和3D细胞培养应用实现空间定义的细胞粘附。被Bioinert生物惰性包围的确定的粘附点能够从细胞悬浮液中捕获所有粘附的单细胞。生物惰性是完全不可附着细胞的。这迫使所有细胞在粘附点处相互聚集,从而以一种确定和可控的方式形成球体 从而以确定和可控的方式形成球体。
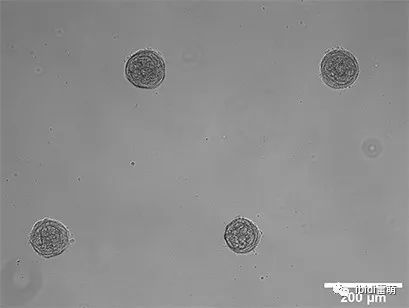
NIH-3T3细胞(小鼠胚胎成纤维细胞)的球体形成。将单个细胞接种于µ-Slide 8 Well With Multi-Cell µ-Pattern腔室载玻片中。明场显微镜,10x物镜。
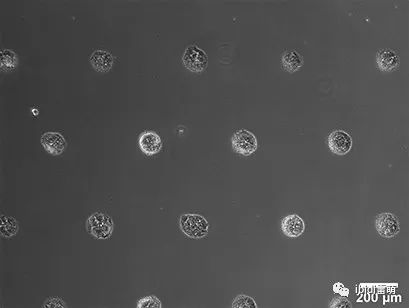
NIH-3T3细胞球状体的形成,在将单细胞接种于µ-Slide VI 0.4 With Multi-Cell µ-Pattern通道载玻片中。相差显微镜,4x物镜。

NIH-3T3细胞(小鼠胚胎成纤维细胞)在200μm粘附点上的球状体形成,记录球状体生成64小时。相差活细胞成像,4x物镜。
当在灌注下培养时,球体生长率大大提高

L929成纤维细胞在µ-Slide spheroid Perfusion,生物惰性(ibidi 80350),第1-14天,接种浓度为5 × 10 5个单细胞/ml。左:不灌注,隔天换药。右: ibidi Pump System 泵系统(流体剪切力系统)灌注,0.75 ml/min。相差显微镜,10 x物镜,孔径800µm。
长期培养球体的活/死染色
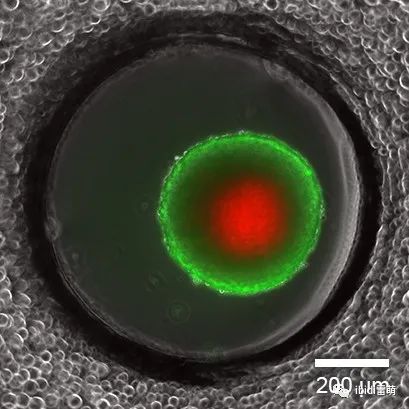
使用 ibidi Pump System 泵系统(流体剪切力系统),灌注培养14天后,在µ-Slide spheroid Perfusion中对L929球体进行活/死FDA/PI染色,0.75 ml/min。绿色:活细胞(二乙酸酸荧光素,FDA);红色:死细胞(碘化丙啶,PI)。宽场荧光显微镜,10x物镜。
PDAC细胞和成纤维细胞的类器官共培养
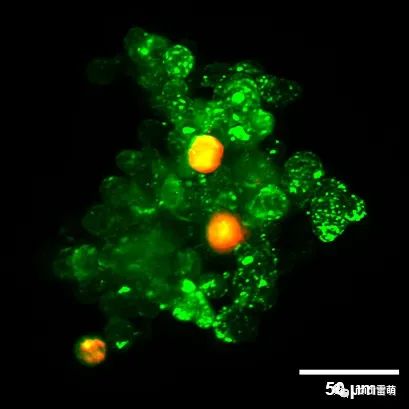
人胰腺癌(PDAC)细胞系PA-TU-8988T(绿色,用CellTrackerTM绿色染色)和小鼠成纤维细胞系mPSC4(红色,用CellTrackerTM橙色CMTMR染色)在µ-Slide Spheroid Perfusion中共培养的类器官。µ-Slide上覆盖25µm FEP箔,以便在垂直光片显微镜中匹配更接近水的折射率。该图像是由S. Volkery在慕尼黑工业大学用M Squared Aurora Airy光束垂直光片装置拍摄的。样品由德国马尔堡大学的K. Roth提供。
HT-1080癌细胞在3D胶原凝胶中的侵袭
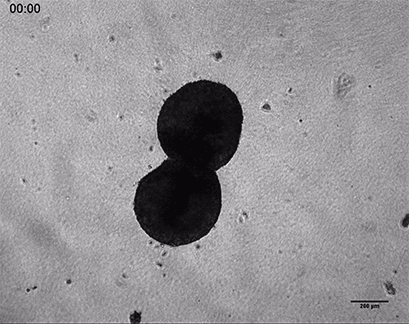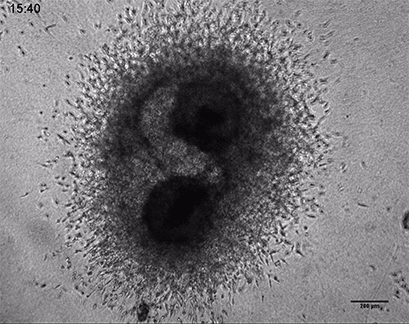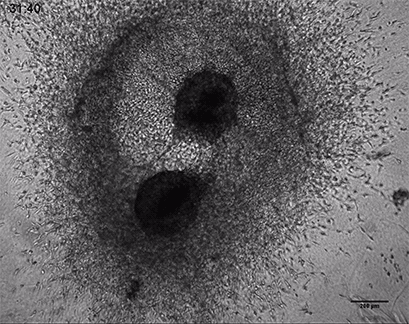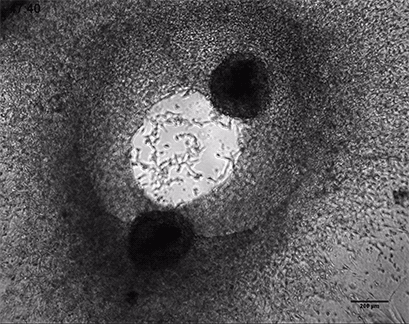
将侵袭性人纤维肉瘤癌球体(HT-1080)包埋于ⅰ型胶原蛋白,大鼠尾凝胶中。在µ-Slide 8 Well中记录对凝胶基质的侵入48小时。4倍物镜,明场。
内皮细胞在3D胶原凝胶中的发芽
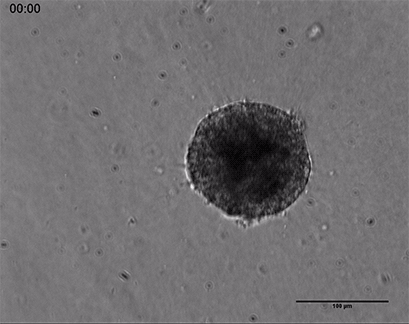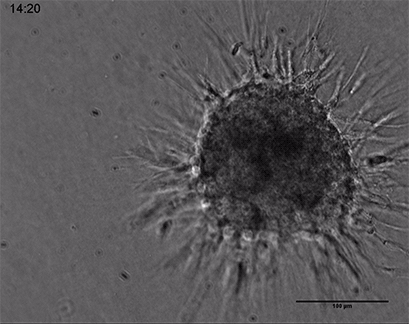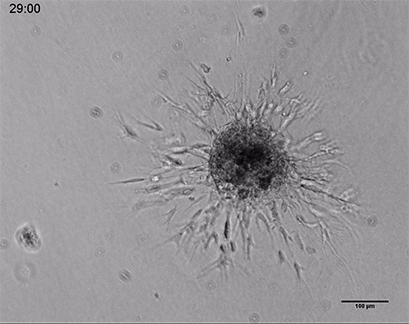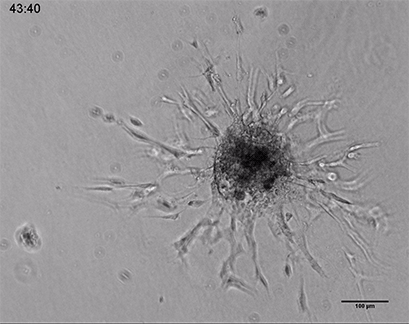
人类脐静脉内皮细胞(HUVEC)球体的活细胞成像,嵌入由I型胶原蛋白,大鼠尾制成的3D凝胶中。在µ-Slide 8孔中记录凝胶基质的发芽过程44小时,10倍和4倍物镜,明场。
L929球体横截面的共聚焦显微镜成像
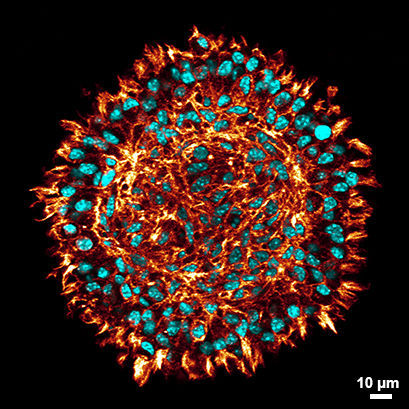
在µ-Slide spheroid Perfusion中清除(红色:phalloidin,青色:DAPI)后,染色的L929球体的横截面共聚焦显微镜。球状体的清除使得甚至在球状体成纤维细胞的中心的细胞可见,同时保持球状体的形态。 更多详情请点击查看“Protocol for Spheroid Culture, Staining, and Clearing for 3D Imaging”.数据由德国慕尼黑工业大学的Julian Hofmann和Selina J. Keppler提供。
3D中的趋化性和迁移分析
3D中I型胶原蛋白凝胶内皮细胞向FCS梯度的趋化性

人脐静脉内皮细胞(HUVEC)包埋在1.5µg/ml I型胶原凝胶中的活细胞成像,在µ-Slide Chemotaxis细胞趋化载玻片中,向胎牛血清迁移。注意:在趋化过程中,细胞相互连接形成字符串。相差,4x物镜,24小时。
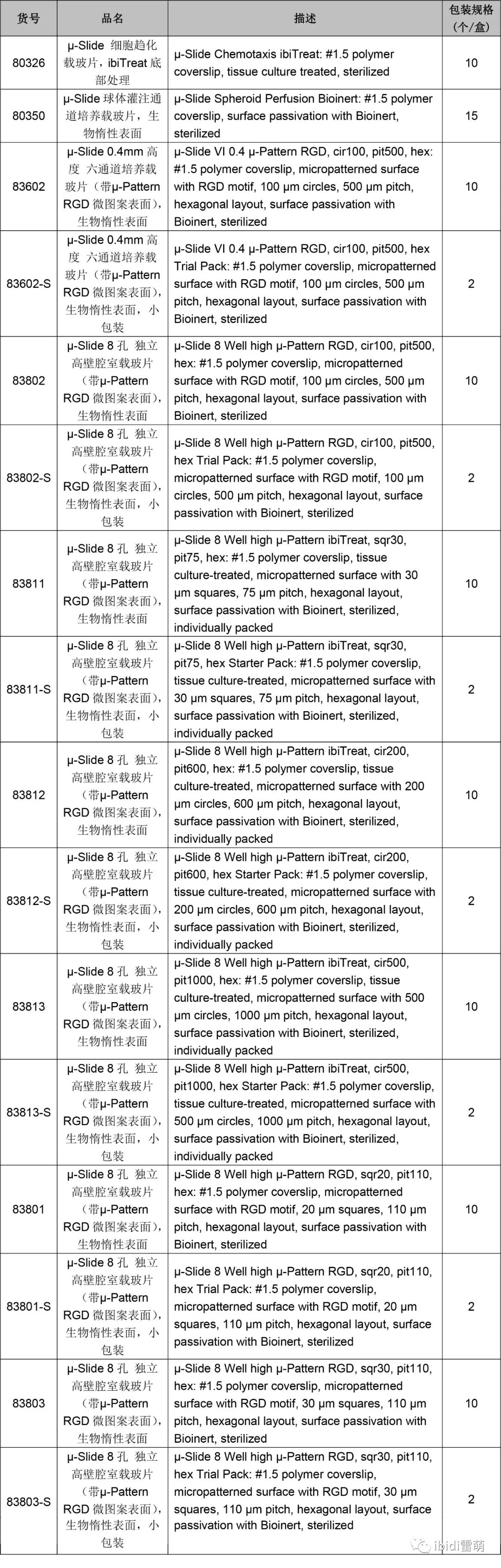
订购信息:
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.