date:2025-05-12 10:12:22
想象一下,你的膝盖受伤了。几乎瞬间,你的身体就会启动修复机制:皮肤细胞迁移以闭合伤口,免疫细胞涌入抵抗感染,血管重组以恢复循环。从胚胎发育的早期阶段到受损组织的再生,细胞迁移是塑造生命本身的核心过程。
细胞并非随机移动——它们遵循精确的信号,以惊人的准确性在组织中穿行。这种迁移能力支撑着器官形成、伤口愈合和免疫防御等关键生物学功能。然而,当这种严格调控的机制失控时,可能引发慢性炎症、自身免疫疾病甚至癌症[1]。
那么,细胞是如何知道该去哪里的?它们如何移动?科学家们如何研究和操纵这些机制,以更好地了解健康和疾病?让我们一起深入探索细胞迁移这一奇妙的世界。
细胞如何移动?为何移动?
细胞虽不会“行走”,但其内部拥有复杂的骨架系统,通过延伸和收缩驱动自身穿过组织。它们的运动高度协调,受外部信号和内部信号级联调控。广义上,细胞迁移机制可分为三类[2]:
•阿米巴样迁移:细胞通过伪足状突起挤过缝隙,类似阿米巴运动。
•间充质迁移:细胞黏附周围结构,利用富含肌动蛋白的片状伪足(lamellipodia)和丝状伪足(filopodia)牵引自身前进。
•集体迁移:细胞群作为协调单元共同移动,在伤口愈合和胚胎发育中至关重要。

迁移策略的多样性
细胞迁移在发育和愈合中的作用
从生命的最初阶段起,细胞就处于运动状态。在发育中的胚胎内,神经嵴细胞通过长距离迁移形成心脏、骨骼和神经系统等结构。若缺乏精确的迁移,将导致出生缺陷和发育障碍。这种高度协调的过程确保器官和组织在正确的时间与位置发育,从而塑造机体的结构与功能[3]。
在生命后期,细胞迁移成为伤口愈合和组织再生的核心机制。当组织受损时,角质形成细胞、成纤维细胞与免疫细胞协同修复损伤。成纤维细胞迁移至伤口处沉积胶原蛋白以形成新组织,内皮细胞通过血管生成新血管以恢复氧气和营养供应[4]。免疫细胞在趋化性引导下涌入损伤部位,对抗感染、清除碎片并调节炎症[5]。这种复杂的细胞协作确保了高效愈合,同时避免慢性伤口或过度疤痕形成。
通过研究发育和愈合中的细胞迁移,科学家得以深入理解细胞如何在其微环境中导航、响应信号并协调运动。Live-cell imaging 活细胞成像技术使研究者能够实时观察这些微小“旅行者”,捕捉细胞如何推动、拉动与协作以构建组织并修复损伤。这些发现不仅揭示了有序迁移的精妙,也展现了失控后的后果——尽管精准迁移对器官构建和伤口愈合至关重要,但细胞的移动能力也可能走向极端:例如在癌症中,失控的细胞挣脱束缚并侵袭新领域。
黑暗面:癌症转移与失控的迁移
虽然受控的迁移对于生命至关重要,但细胞的移动能力也可能导致致命的疾病。癌症最令人恐惧的方面之一是转移,即肿瘤细胞脱离、通过血液或淋巴系统传播并在远处器官中建立继发性肿瘤的过程[6]。癌细胞利用许多与正常细胞相同的机制,但带有一种危险的转变:
•上皮-间充质转化(EMT):增强运动性以脱离原发肿瘤。
•无视停止信号:突破组织屏障。
•劫持血管生成:利用新生血管作为转移通道[7]。这些新血管为癌细胞通过身体迁移提供了直接途径,使它们能够进入远处器官,在那里它们可以建立继发性肿瘤并推动疾病进一步发展。
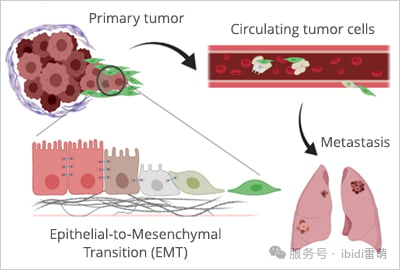
癌症转移中的失控迁移
细胞迁移与癌症之外的疾病
虽然癌症转移是不受控制的迁移最臭名昭著的例子,但异常的细胞运动也与以下其他疾病有关:
•炎症性疾病:在类风湿性关节炎和哮喘等疾病中,免疫细胞过度迁移,导致慢性炎症和组织损伤。
•神经退行性疾病:发育过程中神经元的异常迁移与癫痫和精神分裂症等疾病有关[8]。
•纤维化:当成纤维细胞过度侵袭性迁移时,过多的疤痕组织会在肺(肺纤维化)或肝脏(肝硬化)等器官中形成,从而损害功能[9]。
科学家如何研究细胞迁移?
研究细胞迁移对于理解关键生物学过程至关重要,包括组织修复、免疫反应和癌症转移。然而,传统的迁移分析通常面临重现性、生理相关性和实时观察方面的挑战。研究人员不断改进方法,以克服这些局限性并更深入地了解细胞运动。
伤口愈合实验
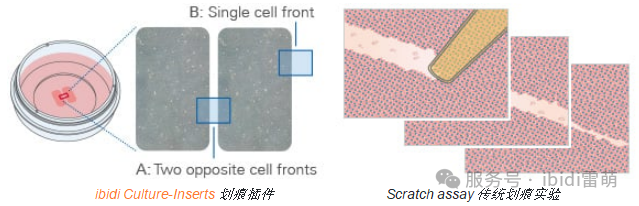
伤口愈合分析用于研究细胞如何迁移以闭合间隙,模拟体内组织修复过程。该技术广泛应用于再生、纤维化和肿瘤细胞迁移的研究。然而,伤口大小和形状的不一致会导致结果的可变性,而机械刮擦可能会影响细胞行为。使用明确的无细胞间隙代替手动刮擦有助于确保更具可重复性和可量化的伤口愈合实验。
ibidi解决方案:与传统的划痕实验相比,ibidi Culture-Inserts划痕插件可创建精确、无细胞和无碎屑的间隙。这使得不同伤口愈合和细胞迁移实验具有出色的可重复性和准确的可比性。
趋化性实验
趋化性分析检查细胞如何响应化学梯度移动,在免疫反应、胚胎发育和癌症转移中发挥着至关重要的作用。
传统方法:Boyden小室缺乏实时可视化,从而将分析限制为终点测量,并且提供的关于迁移模式的见解有限。
ibidi解决方案:µ-Slide Chemotaxis细胞趋化载玻片提供在2D和3D环境中进行实时趋化性测量,从而可以在受控梯度下详细观察细胞运动。这使得研究人员能够连续跟踪迁移动态,从而提供更准确和定量的定向运动和细胞行为分析。

µ-Slide Chemotaxis
出芽和侵袭实验
出芽和侵袭分析用于研究细胞如何侵入周围组织,这是血管生成、癌症转移和组织重塑中的一个重要过程。在出芽分析中,内皮细胞形成新的毛细血管样结构,模拟血管形成。在侵袭分析中,癌细胞或基质细胞迁移到3D基质中,复制肿瘤浸润。
传统方法:通常依赖于复杂的共培养系统或人工支架,可能无法完全复制生理条件。
ibidi解决方案:µ-Slide Angiogenesis和micro-Insert 3D为在特定条件下研究细胞出芽和侵袭提供了可控的环境,ibidi的这些系统支持高分辨率成像,使研究人员能够在更具生理相关性的环境中分析血管形成和肿瘤细胞侵袭的动态。

Transwell迁移实验
Transwell迁移分析通常用于研究细胞如何穿过多孔膜,模拟诸如血脑屏障或内皮层之类的组织屏障。它经常应用于癌症研究、免疫学和药物测试。虽然传统的Transwell分析对于研究细胞迁移有效,但它们可能无法完全复制天然体内条件的复杂性,因为它们通常使用不能完全模拟细胞外基质或组织结构的人工膜。此外,这些分析可能会限制显微镜的可及性和可视化,从而阻碍对细胞行为的实时观察。
ibidi解决方案:micro-Insert 3D提供了一种更相关且更易于访问的替代方案,提供了一种天然的3D环境,无需使用人工膜,从而可以更好地进行显微镜观察,并准确观察在更接近天然组织条件下的细胞侵袭和迁移。

微流控实验
微流控系统使研究人员能够研究流体流动和剪切应力如何影响细胞迁移——这些因素在血管生物学、转移和组织工程中起着至关重要的作用。传统的静态培养条件无法复制这些动态环境,从而限制了迁移研究的生理相关性。整合了受控流动条件的实验装置可帮助研究人员分析剪切应力和间质流动如何影响细胞运动和粘附。
传统静态培养无法模拟血流剪切力。
ibidi解决方案:µ-Slide I Luer 3D载玻片与ibidi Pump System泵系统相结合,能够对细胞的穿膜迁移进行可控研究。将内皮细胞置于管腔侧,癌细胞置于基底层侧,模拟体内条件,可施加剪切应力以进行真实的流体流动研究。
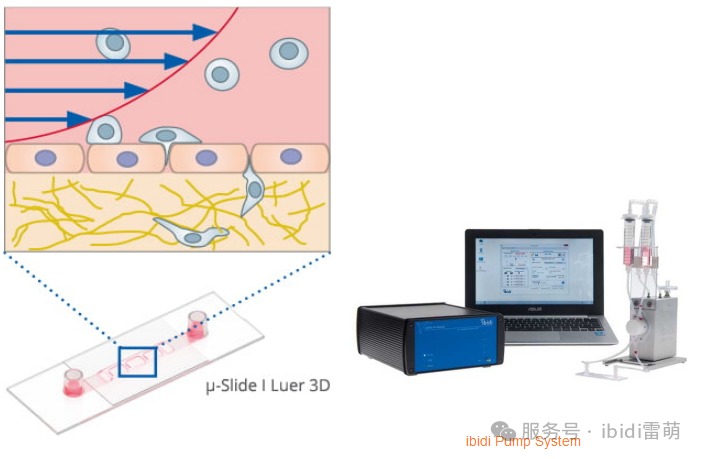
研究细胞迁移ibidi解决方案与传统方法对比的凸显优势

细胞迁移研究的未来展望
细胞迁移是生物学中最基本但又最复杂的过程之一。它决定了我们如何发育、如何愈合,以及 ——当出现问题时——疾病如何发展。通过研究这一复杂的过程,研究人员可以解锁从伤口愈合到癌症治疗的各种新疗法。
借助先进的活细胞成像、micropatterned environments微图案化环境[10]和微流控系统等前沿工具,科学家们现在能够以前所未有的精度观察和操控细胞迁移。这些技术正在为未来的发现铺平道路,也许有一天,它们将帮助我们阻止癌症的发展,加速组织再生,并更好地理解细胞层面的生命奥秘。
在我们继续探索细胞的 “大逃亡” 时,有一点是明确的:理解迁移不仅仅是观察细胞的移动 —— 而是要揭开生命本身的奥秘。
参考文献
[1] Pourjafar, M. and V.K. Tiwari, Plasticity in cell migration modes across development, physiology, and disease. Frontiers in Cell and Developmental Biology, 2024. 12.
[2] Kunwar, P.S., D.E. Siekhaus, and R. Lehmann, In vivo migration: a germ cell perspective. Annu Rev Cell Dev Biol, 2006. 22: p. 237-65.
[3] Kurosaka, S. and A. Kashina, Cell biology of embryonic migration. Birth Defects Res C Embryo Today, 2008. 84(2): p. 102-22.
[4] Mayya, C., et al., Mechanisms of Collective Cell Migration in Wound Healing: Physiology and Disease, in Wound Healing Research: Current Trends and Future Directions, P. Kumar and V. Kothari, Editors. 2021. Springer Singapore: Singapore. p. 55-74.
[5] Delgado, M.G. and A.-M. Lennon-Duménil, How cell migration helps immune sentinels. Frontiers in Cell and Developmental Biology, 2022. 10.
[6] Aceto, N., et al., Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis. Cell, 2014. 158(5): p. 1110-1122.
[7] Reisenauer, K., The Other EMT: Exploring the controversial driver of metastasis, Z. Tang, Editor. 2019: Oncobites,The Latest in Cancer Research, simplified.
[8] Esteve, D., et al., Adult Neural Stem Cell Migration Is Impaired in a Mouse Model of Alzheimer's Disease. Mol Neurobiol, 2022. 59(2): p. 1168-1182.
[9] González, D., et al., Role of WISP1 in Stellate Cell Migration and Liver Fibrosis. Cells, 2024. 13(19).
[10] Li, Y., et al., Advances in Regulating Cellular Behavior Using Micropatterns. Yale J Biol Med, 2023. 96(4): p. 527-547.
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.