date:2025-06-09 10:09:48
引言
类器官可能看起来像简单的细胞团块,但它们正在改写疾病建模的规则。在世界各地的实验室中,微小的3D人类细胞团正在自我组织成类似于微型器官的结构——揭示了组织发育、功能和衰竭的复杂性[1]。欢迎来到类器官的世界:自我组织的3D细胞培养,它们正在重塑我们研究人类生物学和疾病的方式。
类器官不仅仅是2D培养的技术改进——它们是一种范式转变。它们既提供了体内模型的结构复杂性,又保留了体外实验的可及性。对于研究阿尔茨海默病背后机制、测试结直肠癌药物反应或模拟病毒感染影响的研究人员来说,类器官提供了一个独特的窗口来观察生命系统,而无需离开实验室工作台。
是什么让类器官如此独特?
类器官最重要的贡献之一是它们能够作为更准确的疾病模型。通过密切模拟人类组织的细胞复杂性和功能,类器官弥合了简化的体外模型和复杂的体内系统之间长期存在的差距。传统的2D培养通常无法捕捉组织的三维组织,而动物模型在代表人类特异性反应方面可能存在不足。然而,类器官提供了一个折中方案——既具有体外系统的可扩展性,又具有更接近人体器官的生理相关性[2]。
类器官真正令人兴奋的地方在于它们能够自我组织成不仅反映真实组织的结构,而且反映其发育动态的结构。这不仅仅是模仿外观——它们还表现出行为和反应,为我们了解人类器官如何形成、适应或功能障碍提供了一个窗口。它们在具有多因素原因和复杂组织相互作用的疾病中具有重要意义。
类器官可以源自多种细胞来源,包括患者特异性干细胞、成人组织干细胞,甚至肿瘤活检。这种多功能性既可以实现个性化的疾病建模,也可以实现对发育和病理的标准化研究。
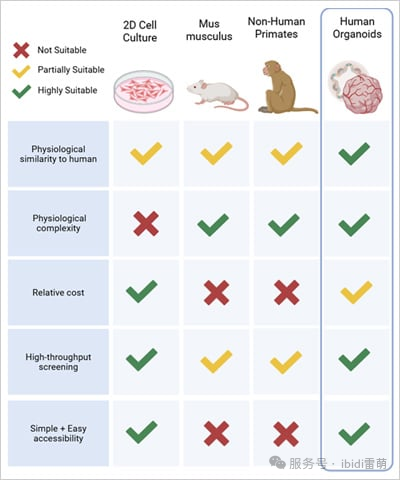
图1|类器官与其他模型系统的比较。改编自Sun, X., et al.,2023 [3]
类器官的应用
类器官比传统模型提供更高的临床保真度,并且具有成本效益和效率,从而能够更准确地进行疾病模拟和快速的药物功能测试。目前,类器官主要用于四个关键领域:
1.疾病建模
类器官已成为研究器官发育和疾病机制的有力工具,其环境与人类生理非常相似。它们源自患者组织或多能干细胞,保留了原生的遗传和功能特征,因此非常适合研究从神经发育和传染病到代谢紊乱和癌症的广泛疾病。
在癌症研究中,肿瘤来源的类器官保留了原始肿瘤的遗传异质性和结构,包括与基质细胞和免疫细胞的相互作用。这使得研究人员能够以患者特异性的方式探索肿瘤进展、侵袭和耐药性的机制。类器官已被证明在重现复杂的肿瘤微环境方面特别有用,并且现在被用于实时预测治疗反应[4]。
在神经系统疾病领域,大脑类器官能够研究人类大脑发育、突触形成和神经炎症——这些过程在动物中难以建模[5]。它们提供了对诸如阿尔茨海默病、自闭症谱系障碍、癫痫和小头畸形等疾病的见解。 值得注意的是,大脑类器官可以重现诸如tau聚集和淀粉样斑块发育等特征,从而为研究神经退行性疾病和测试靶向疗法提供了一个生理相关的平台。
它们具有模拟早期疾病过程、组织特异性病理和患者变异性的能力,这使得类器官对于发现疾病机制、识别新的治疗靶点以及在与人类相关的条件下验证实验性干预措施具有不可估量的价值。
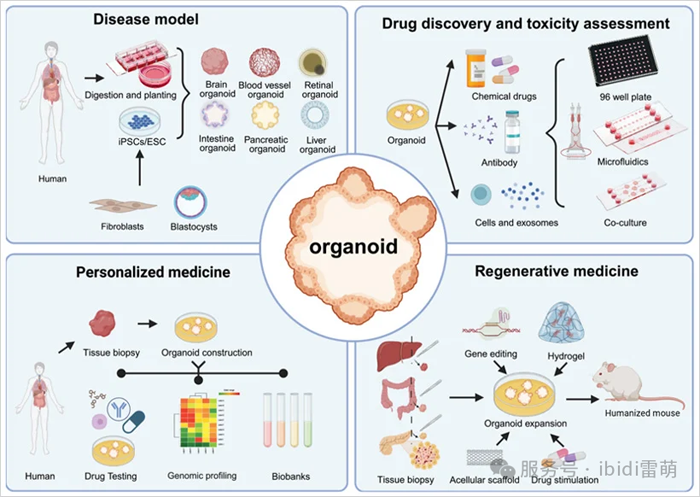
图2|类器官的四个主要应用。改编自Sun, X., et al.,2023 [6]
2.药物发现赫毒性筛选
制药行业面临着巨大的压力,需要在降低开发成本的同时,找到安全有效的药物。类器官通过提供可扩展的、高通量的平台来模拟真实组织反应,从而提供了一种解决方案[7]。研究人员现在可以在患者来源的类器官模型中筛选数百种化合物,以评估治疗潜力和毒性。例如,肝脏和肾脏类器官被用于检测脱靶效应,而肿瘤类器官被用于预测对化疗或靶向药物的反应。将这些分析与微流控和人工智能驱动的成像分析相结合,可进一步提高通量和精确度。
3.再生医学
类器官不仅仅是模型——它们是组织替代的蓝图。它们在再生医学中的应用包括重建受损组织、支持器官修复以及潜在地作为可移植的构建块。生物打印、支架工程以及与免疫或血管细胞共培养系统的进步已经突破了可能的界限。虽然临床应用仍处于早期阶段,但来自肠道、视网膜和肝脏组织的类器官已在临床前模型中显示出恢复丧失的功能和逆转退化的前景[8]。
4.个性化医疗
类器官最具变革性的应用之一是为个体患者量身定制治疗方案。通过培养来自患者来源组织的类器官,临床医生可以在给药前在体外测试药物疗效和耐药性。这种方法已经在结直肠癌、乳腺癌和胰腺癌等癌症中显示出临床价值,其中肿瘤异质性通常导致不同的治疗结果。例如,在囊性纤维化中,当仅靠遗传学不足以指导治疗决策时,基于类器官的分析已指导了治疗决策。为了说明这种方法的影响,让我们看一个真实的例子:
案例研究:囊性纤维化和个性化药物测试[9]
类器官应用的一个引人注目的真实案例可以在囊性纤维化(CF)研究中找到。科学家们从患者干细胞中培育出肠道类器官,并利用功能性膨胀分析来评估CFTR调节药物的有效性。这些类器官会因离子和水的流入而膨胀,从而对有效治疗做出反应——这是药物起效的直接视觉提示。
这种分析使临床医生能够预测具有罕见或知之甚少的CFTR突变的个体的药物反应。在许多病例中,它为个性化治疗提供了指导,而在这些病例中,仅靠基因检测并不能提供明确的治疗方案。该模型说明了类器官在药物测试中的强大作用,并展示了其在精准医疗中的临床实用性。
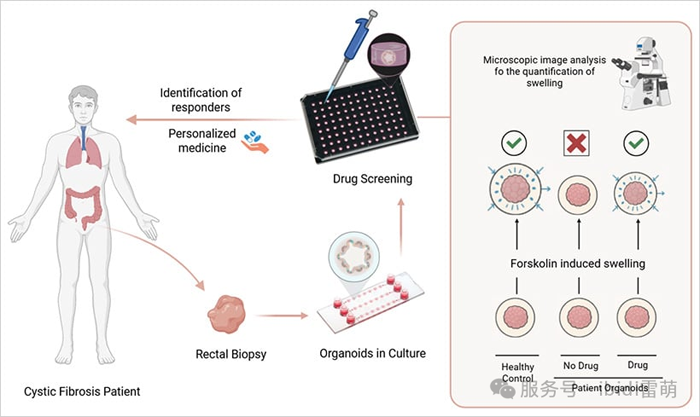
图3|评估患者来源的类器官中的CFTR功能
赋能技术:智能平台的作用
类器官研究在很大程度上依赖于支持性技术,就像依赖于细胞本身一样。现代平台能够实现精确的凝胶处理、长期灌注和先进的成像——所有这些对于可重复且生理相关的实验至关重要。
像 µ-Slide Spheroid Perfusion 这样的微流控工具提供可控的流动来模拟体内条件,支持对生长、药物反应和组织结构的实时研究。
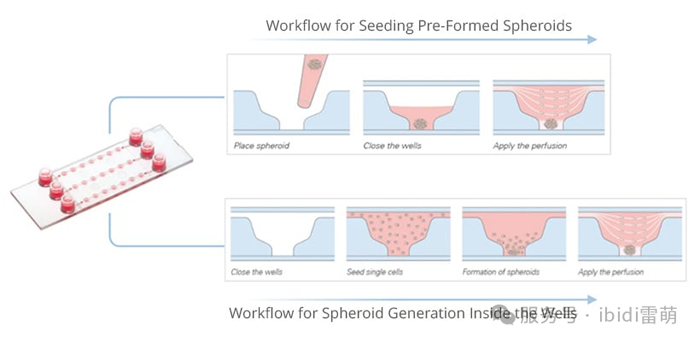
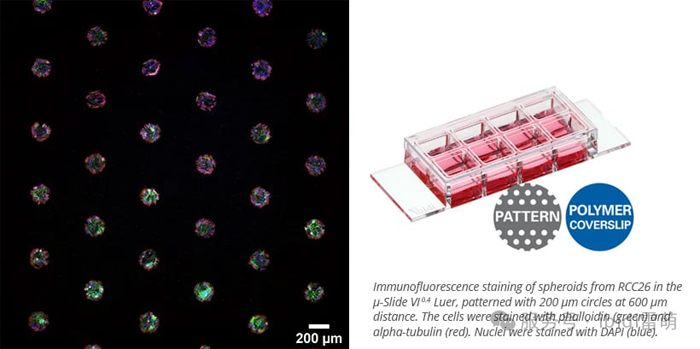
ibidi 的 µ-Patterning 技术可利用带有图案点的非粘性表面实现空间定义的细胞粘附。这种设置非常适合生成均匀的球体、研究细胞行为或使用高分辨率成像进行CAR-T细胞杀伤测定。
最后,µ-Plate 96 Well 3D 将高通量能力与最小的凝胶使用量和卓越的光学质量相结合——使其成为以标准化、高效的方式进行筛选、3D细胞培养和实时成像的理想选择。
超越单一类器官:组装类器官系统
虽然传统的类器官提供了对单个器官行为的见解,但许多人类疾病涉及多个组织之间的串扰。这导致了多器官类器官系统(也称为组装类器官)的出现,该系统结合了不同的类器官——例如大脑-脊髓或肠道-肝脏——以更好地复制生理相互作用。这些模型越来越多地用于在单个平台上研究发育、全身药物效应、激素信号传导和免疫-器官通讯。它们的复杂性为模拟跨越多个器官系统的疾病和构建更全面的芯片上身体平台开辟了新的可能性。
最近的一个例子涉及一个心肾单元,其中来自hiPSC的心脏和肾脏类器官在微流控芯片上组合在一起[10]。使用 µ-Slide III 3D 灌注,研究人员在静态和流动条件下保持了两种类器官的结构和功能完整性。该系统证明了灌注下类器官共培养如何能够支持未来对器官间信号传导和疾病机制的研究——使该领域更接近完全集成的器官水平建模。
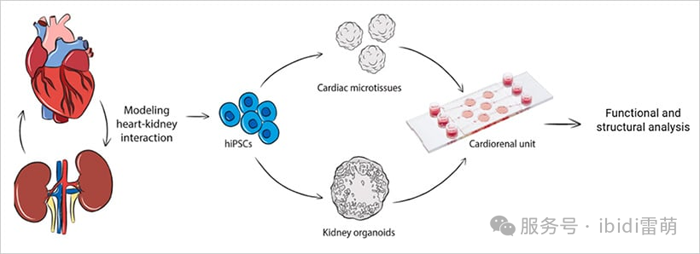
图4|用于研究器官间串扰的双类器官系统[10]
结论
随着科学不断突破我们可以在人体外复制的界限,类器官正处于创新的前沿。这些微小的、类似器官的细胞团正在帮助科学家完成从疾病建模到新药测试的所有工作,而这一切都离不开实验室。
随着我们不断改进这些模型并开始将AI、组学和生物工程融入其中,我们正朝着一个个性化的、器官水平的洞察力从实验室到临床床边塑造医学的未来迈进。
要了解更多关于球状体、类器官和3D细胞培养的信息,可查看(ibidi雷萌)公众号中的3D细胞培养合集,或联系我们索要3D细胞培养应用指南。
参考文献:
[1] Yi, S.A., et al., Bioengineering Approaches for the Advanced Organoid Research. Adv Mater, 2021. 33(45): p. e2007949.
[2] Kim, J., B.-K. Koo, and J.A. Knoblich, Human organoids: model systems for human biology and medicine. Nature Reviews Molecular Cell Biology, 2020. 21(10): p. 571-584.
[3] Sun, X., et al., A narrative review of organoids for investigating organ aging: opportunities and challenges. Journal of Bio-X Research, 2023. 06(01): p. 3-14.
[4] Fang, Z., et al., The role of organoids in cancer research. Experimental Hematology & Oncology, 2023. 12(1): p. 69.
[5] Birtele, M., M. Lancaster, and G. Quadrato, Modelling human brain development and disease with organoids. Nature Reviews Molecular Cell Biology, 2025. 26(5): p. 389-412.
[6]Yao, Q., et al., Organoids: development and applications in disease models, drug discovery, precision medicine, and regenerative medicine. MedComm, 2024. 5(10): p. e735.
[7] Vandana, J.J., et al., Human pluripotent-stem-cell-derived organoids for drug discovery and evaluation. Cell Stem Cell, 2023. 30(5): p. 571-591.
[8] Wu, Y., et al., Application of Organoids in Regenerative Medicine. Stem Cells, 2023. 41(12): p. 1101-1112.
[9] Dekkers, J.F., et al., Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science Translational Medicine, 2016. 8(344): p. 344ra84-344ra84.
[10] Gabbin, B., et al., Heart and kidney organoids maintain organ-specific function in a microfluidic system. Mater Today Bio, 2023. 23: p. 100818.
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.