date:2025-09-28 13:35:59
前言
本应用说明介绍了一种在µ-Slide VI 0.4 µ-Pattern ibiTreat(cir200. pit600. hex)微图案六通道载玻片上培养、固定及染色细胞或细胞球状体的简单方案。ibidi µ-Patterns在ibidi Polymer聚合物盖玻片上提供空间定义的ibiTreat(组织培养处理)粘附微图案区域,周围区域环绕着生物惰性Bioinert(ULA),以确保细胞仅在定义的微图案区域形成3D聚集体。
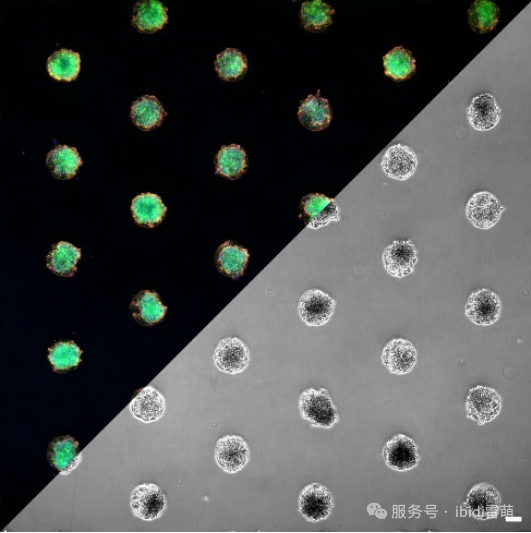
在此示例中,人肝细胞(Huh7)培养在多细胞阵列上,并用福尔马林溶液固定,F-肌动蛋白细胞骨架、α-微管蛋白和细胞核被标记用于荧光显微镜观察。
1. 实验材料
1.1 试剂与缓冲液
* 贴壁细胞,例如Huh-7(JCRB: #JCRB0403)
* 细胞培养基;例如,含10%胎牛血清(Gibco,10270106)的基础培养基RPMI-1640(Gibco,11875093)
* 磷酸缓冲盐溶液(PBS;14190144.Gibco)
* Accutase(A11105.Gibco),或其他适合用于细胞收集的解离试剂
* 磷酸缓冲盐溶液(PBS;14190144.Gibco)
* 福尔马林,10%,即用型(HT5011.Sigma Aldrich)
* Triton-X-100(A16046.Thermo Fisher Scientific)
* 透化缓冲液(含0.5% Triton-X-100的PBS)
* 牛血清白蛋白(BSA)(A1470-10G,Sigma Aldrich)
* 封闭缓冲液(含1% BSA的PBS)
* 抗体稀释缓冲液(1% BSA和0.05% Triton-X-100溶于PBS)
* 鬼笔环肽-iFluor 488(ab176753.Abcam)
* 单克隆抗-α-微管蛋白抗体(T5168.Sigma-Aldrich)
* 抗小鼠IgG-Atto 594二抗(76085.Sigma-Aldrich)
* 含DAPI的ibidi封片剂(50011.ibidi)
* ibidi浸油2(50102.ibidi)
1.2 设备
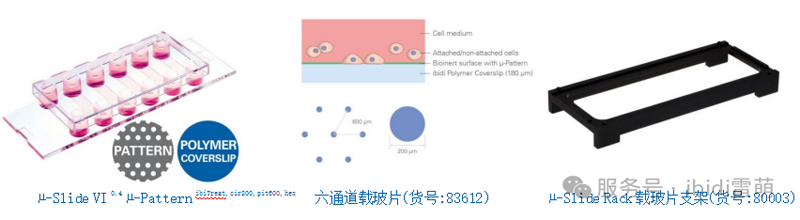
* µ-Slide VI 0.4 µ-Pattern ibiTreat, cir200. pit600. hex (83612. ibidi)
* µ-Slide Rack 载玻片支架(80003. ibidi)
* 标准细胞培养设备(移液器、无菌工作台、细胞培养箱、培养瓶、细胞培养基、血细胞计数板等)
* 具有相应滤光片组的倒置荧光显微镜
2. 实验步骤
2.1 细胞接种与培养
操作µ-Slide VI 0.4 µ-Pattern ibiTreat cir200. pit600. hex 前请阅读说明书。所有步骤均需在无菌条件下进行。建议在接种细胞前一天将载玻片和细胞培养基置于培养箱中,以避免操作过程中产生气泡。在实验开始前,请将Huh-7细胞接种于标准细胞培养瓶(例如T75培养瓶)中,使细胞贴壁生长于瓶底。实验当天,细胞应处于亚汇合状态且状态良好。
整个操作过程中需快速进行,以防止细胞干燥。
除非另有说明,所有提及的体积均指每通道所需体积,所有孵育步骤均在室温下进行。
* 向T75培养瓶中加入10 ml Accutase用于细胞解离;在培养箱中(37 °C,5 % CO₂)孵育5分钟。
* 收集细胞悬液,离心,并用少量细胞培养基稀释以进行计数。
* 计数细胞,并用细胞培养基调整至最终浓度为0.5–3 × 106个细胞/毫升。
注意:根据所使用的细胞类型和实验需求优化细胞接种浓度。如需进一步了解影响细胞在ibidi µ-Patterns上附着的重要参数,请点击查看
Application Note 65: Cell Adhesion on ibidi µ-Patterns: Parameters and Optimization.
* 拆开µ-Slide VI 0.4 µ-Pattern ibiTreat cir200. pit600. hex 载玻片,将其放置在µ-Slide载玻片支架或适当的表面上。
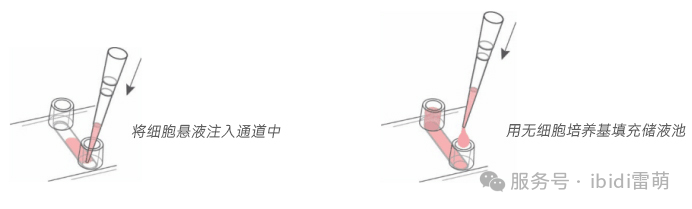
* 用移液器直接将30 µl细胞悬液加至每个通道中。快速加样有助于避免气泡滞留。对所有通道重复此操作。
* 如有必要,通过倾斜µ-Slide并轻敲其一侧边缘,去除通道中滞留的气泡。
* 用随附的盖子盖住储液池。
* 将载玻片连同支架放入培养箱(37°C,5% CO2)中,让细胞贴壁1小时。
* 向每个储液池中加入60 µl无细胞的细胞培养基。避免气泡滞留。
* 将载玻片连同支架放入培养箱(37°C,5% CO2)中,将细胞培养过夜。
* 如有必要,次日可用无细胞培养基洗涤以去除未贴壁的细胞和碎片。
* 对于长期细胞培养,建议每1-2天进行一次持续的培养基更换(见本文2.2 通道中的洗涤与持续培养基更换 )。在本示例中,细胞在图案上培养了10天。
2.2 通道中的洗涤与持续培养基更换
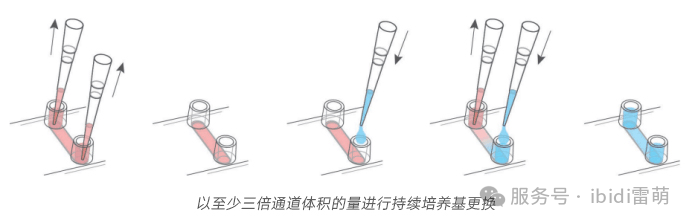
* 小心移除储液池中的培养基。吸液时远离通道,以防将通道内的液体一并吸出。
* 轻柔地将120 µl无细胞培养基加入一个储液池,以补充通道中的培养基。
* 吸出对侧储液池中的旧培养基。使用细胞培养吸液装置时需格外小心,以免冲走部分已贴壁细胞或细胞团。
* 每个储液池使用60 µl无细胞培养基进行补液。
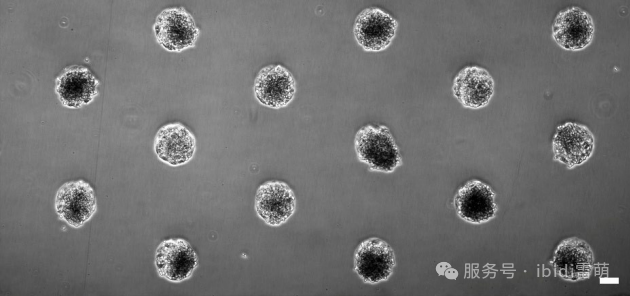
Huh-7细胞在六通道载玻片ibiTreat µ-Pattern (200 µm circles, 600 µm pitch, hexagonal)上培养10天后的相差显微镜图像。比例尺=100 µm
2.3 固定、透化与封闭
* 所有步骤需快速进行,以确保通道不会干燥。吸液时避免直接从通道中吸取,以防将通道内的液体吸走。为实验准备足量的透化缓冲液和封闭缓冲液。
* 通过持续培养基更换,用PBS替换细胞培养基进行洗涤(见本文2.2 通道中的洗涤与持续培养基更换)。
* 吸出储液池中大部分PBS。切勿将整个通道内的液体全部吸干。
* 用100 µl福尔马林(10%)固定细胞20分钟。
* 通过持续培养基更换,用200 µl PBS洗涤细胞两次。
* 吸出储液池中的PBS。注意不要将通道内的全部液体吸干。
* 向其中一个储液池中加入100 µl透化缓冲液,孵育细胞5分钟。
* 通过持续培养基更换,用200 µl PBS洗涤细胞两次。
* 吸出储液池中的PBS。注意不要将通道内的液体全部吸干。
* 用100 µl封闭缓冲液在室温下封闭20分钟。
* 按照前述步骤,用200 µl PBS洗涤细胞两次。
2.4 染色
* 在抗体稀释缓冲液中稀释鬼笔环肽和抗-α-微管蛋白抗体(均按1:500稀释,或根据制造商的建议)制备一抗染色液。
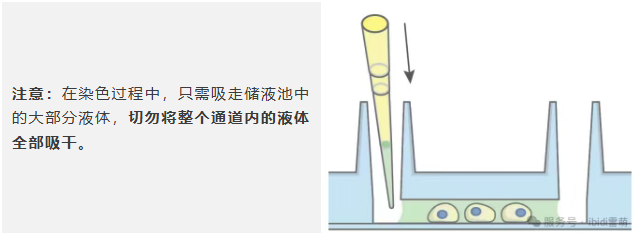
* 通过持续更换,用100 µl一抗染色液替换通道中的封闭缓冲液,然后在避光条件下孵育过夜。
* 按照前述步骤用PBS洗涤两次。
* 在抗体稀释缓冲液中稀释二抗(1:500.或根据制造商的建议)制备二抗染色液。
* 用100 µl二抗染色液替换通道中的PBS,并在室温避光孵育1小时。
* 用PBS洗涤三次。
2.5 封片
* 吸出所有PBS(此时可吸走整个通道内的液体!),并立即加入含DAPI的ibidi封片剂(ibidi Mounting Medium With DAPI)进行细胞核染色,直至通道充满。如果使用其他封片剂,请注意其必须为非干燥型,以避免损坏µ-Slide载玻片。
* 避光于4 °C保存直至成像。
* 染色后的µ-Slide可保存长达4周。但建议尽快进行成像,因为存放时间过长可能会降低图像质量。
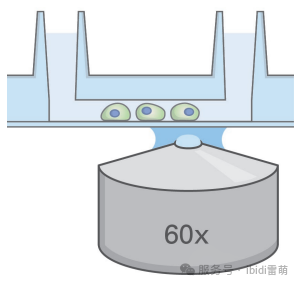
2.6 成像
* 使用配备适当滤光片的荧光显微镜观察细胞,必要时可滴加ibidi浸油。
* 可选:叠加通道图像以生成合并图像。
3. 实验结果
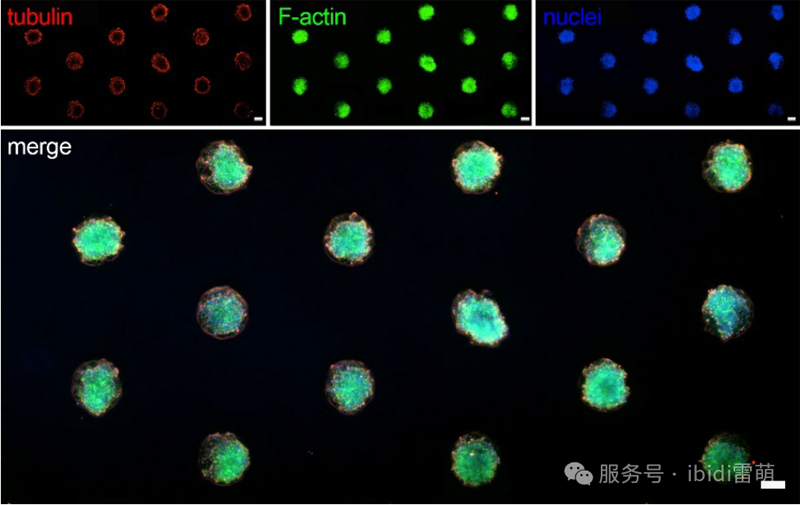
Huh-7细胞在µ-Slide VI 0.4六通道载玻片中,贴附于ibiTreat µ-Pattern(200 µm circles, 600 µm pitch, hexagonal)微图案表面的宽场荧光显微镜图像。F-肌动蛋白细胞骨架通过鬼笔环肽(绿色)进行可视化。细胞核用DAPI染呈蓝色,微管蛋白呈红色。成像在尼康TiE倒置显微镜上使用4倍物镜进行。比例尺=100 µm。
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.