date:2025-11-28 11:40:53
更智能的成像:当AI遇见自动化细胞显微镜技术
近年来,自动化与人工智能的结合彻底改变了细胞成像领域。自动化技术的到来率先改变了成像的日常实践,它通过自动化重复性工作并大规模标准化采集过程,从而重塑了细胞成像。例如,自动化载物台能够可靠地对数百个孔板进行聚焦;采集软件能在不同孔板之间应用一致的曝光和照明设置;培养系统能维持稳定的温度和CO₂浓度,使活细胞能够自然生长。这些自动化技术的应用,带来了更清晰、可重复的图像,显著减少了人工操作和变异的来源。
随后,人工智能(AI)成为下一个重要的技术层。它通过检测细胞和细胞器,并测量跨通道和时间序列中的强度、纹理、形状及运动,将海量图像数据转化为定量的分析结果。机器学习,尤其是深度学习的最新进展,使得模型能够识别简单和复杂成像数据中隐藏的细微结构[1]。深度学习模型可以直接从数据中学习表型,区分健康与应激细胞,根据化合物的效果进行分组,并识别肉眼难以察觉的表面模式。其带来的巨大优势在于速度、客观性和深度,模型能够对每一帧图像应用相同的评判标准。
自动化和人工智能共同催生了一种新的显微镜技术,即高内涵成像 (High-Content Imaging)。通过结合自动化采集和智能分析,研究人员能够超越简单的快照式观察,生成丰富、多维的数据集,从而描述细胞的行为、相互作用以及它们如何响应周围环境[2]。
何为高内涵成像?
高内涵成像(High-Content Imaging,HCI)将自动化和人工智能在一个单一工作流程中结合起来。自动化显微镜跨越多个孔板捕获数千张图像,而分析管道则从每个孔中的每个细胞提取详细信息。HCI不依赖于单一的检测指标,而是测量广泛的参数,包括形态、荧光强度、蛋白质定位和细胞器行为。
由于工作流程是自动化的,每个孔板都在一致的条件下进行成像。先进的软件可以维持焦点、曝光和照明,确保生成的数据集既可重复又可比较。现代自动化显微镜配备了荧光和共聚焦成像功能,结合AI分析软件,能够提高表型分析的通量和准确性,使大规模筛选比以往任何时候都更快、更可靠[3]。其最终结果是一个精确的表型图谱,能够捕捉细胞如何跨越空间和时间对药物、刺激或基因变化做出响应。
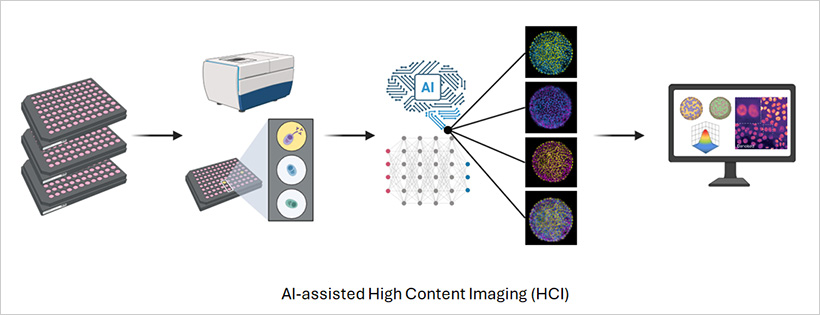
图1 | 高内涵成像实验示意图
为了支持这一工作流程,成像级的实验室耗材起着至关重要的作用。ibidi的 µ-Plate 96 Well 3D, µ-Plate 96 Well Square, µ-Plate 96 Well Round, 和µ-Plate 384 Well Glass Bottom专为高通量显微镜而设计。其#1.5 Polymer聚合物或#1.5H Glass玻璃盖玻片底部为荧光和共聚焦成像提供了所需的光学清晰度,而黑色壁的设计则最大限度地减少了孔间串扰。这些特性确保了所捕获的每张图像在质量上都保持一致,并为基于AI的分析做好准备。

自动化与人工智能的协同优势
自动化与人工智能结合的强大之处在于二者的互补性:自动化生成海量、一致性的数据集,人工智能从中提取意义。二者协同可加速科学发现,提高实验的可重复性,并拓展可测量内容的边界。
规模与速度
自动化成像系统可以在几分钟内处理整块多孔板,在无人干预的情况下捕获数千张图像。某些设置甚至能在短短两小时内完成四十块96孔板的成像。这种规模使得研究人员能够探索完整的化合物库、进行大规模基因筛选或开展手动实验无法完成的延时实验。自动化使高通量成像既高效又常规化,让研究人员能够将精力集中在数据解读而非图像采集上。
洞察深度
人工智能从每张图像中提取数百个参数,揭示随时间演变的细微形态或分子变化。深度学习(尤其是卷积神经网络 (CNNs))已成为图像分析的基石[4]。这些模型能直接从数据中学习表型特征,识别健康细胞与应激细胞的差异,根据表型特征分类化合物效应,并发现肉眼不可见的新细胞状态[5]。一旦模型训练完成,同一模型可在数分钟内分析新数据集,完成人类分析师需耗时数日甚至数周的工作。这使显微镜从描述性工具蜕变为理解细胞行为的丰富、定量平台。
可重复性与客观性
自动化确保成像条件完全一致。人工智能对每帧图像应用相同的客观规则,从而减少偏差并提升跨培养板、仪器及地点的可重复性。这种一致性对大规模、多中心实验至关重要,有助于将成像技术真正转化为一门定量学科。
与3D模型的兼容性
随着生物学向更逼真的模型发展,人工智能与自动化技术使3D球体、类器官及共培养体系的研究精度可媲美2D系统[6][7]。自动化显微镜能穿透厚样本保持聚焦,人工智能算法则可随时间推移重建并量化3D结构(图2a)。在患者来源类器官研究中,高内涵成像结合人工智能技术已能预测个体肿瘤对特定药物的反应,为数据驱动的精准医疗铺平道路[8]。

ibidi µ-Plate 96 Well 3D 96孔3D培养板支持均匀的球体形成和长时程稳定成像,为复杂模型的定量高内涵成像提供可靠平台。
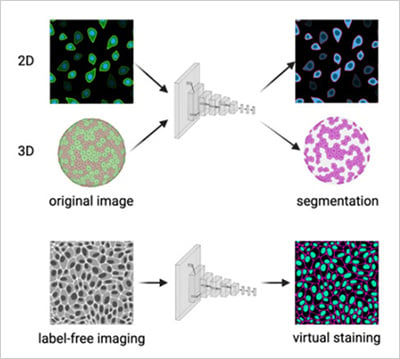
图2 | a) 卷积神经网络对2D与3D显微数据集进行细胞分割。b) 卷积神经网络从无标记明场图像预测荧光通道(虚拟染色)。改编自Carreras-Puigvert, J., et al., 2024[11]。
新发现与预测性洞察
人工智能检测细微模式的能力催生了新型生物学发现。深度学习可按作用机制对化合物进行分组,揭示脱靶效应,并识别疾病早期标志物。在活细胞成像中,人工智能现可实时追踪细胞运动、分裂及形态变化,揭示细胞如何动态响应药物或基因扰动。这使延时成像成为高内涵筛选的核心组件,为细胞响应动力学研究提供关键洞察[9][10]。
为保障长期活细胞实验的稳定性与可重复性,ibidi Stage Top Incubators(载物台培养箱/活细胞工作站)可在显微镜载物台上直接精准控制温度、湿度、CO₂及O₂浓度。该技术确保细胞在长期延时研究中保持最佳健康状态与恒定成像条件。
与此同时,新型生成式人工智能模型正被用于预测分析,能够模拟细胞反应,或基于现有成像数据提出新的实验条件(图2b)。

智能成像的未来
人工智能、自动化与先进显微技术的融合,正在重塑科学家从图像中获取知识的边界。不久的将来,人工智能不仅能分析数据,更能实时引导显微镜操作——自动调节焦距、识别关键事件,或在必要时触发更高分辨率的成像。
贯穿样本制备、图像采集、分析与可视化的全流程成像管道已初现雏形。随着技术持续进步,更快速、更精准、更具预测性的成像,使研究者能够以前所未有的深度和规模来测量与解读细胞过程。

对科学家而言,这意味着将花费更少的时间在重复性工作上,而将更多的时间用于解读生物学数据。而对于细胞成像本身而言,这标志着它正从仅仅“观察生命”转向借助自动化和人工智能的联合力量来“理解生命”。
参考文献
[1] Wong, F., et al., Discovery of a structural class of antibiotics with explainable deep learning. Nature, 2024. 626(7997): p. 177-185.
[2] Way, G.P., et al., Evolution and impact of high content imaging. SLAS Discovery, 2023. 28(7): p. 292-305.
[3] Kupczyk, E., et al., Unleashing high content screening in hit detection – Benchmarking AI workflows including novelty detection. Computational and Structural Biotechnology Journal, 2022. 20: p. 5453-5465.
[4] Gupta, A., et al., Deep Learning in Image Cytometry: A Review. Cytometry Part A, 2019. 95(4): p. 366-380.
[5] Pachitariu, M. and C. Stringer, Cellpose 2.0: how to train your own model. Nature Methods, 2022. 19(12): p. 1634-1641.
[6] Choo, N., et al., High-Throughput Imaging Assay for Drug Screening of 3D Prostate Cancer Organoids. SLAS Discovery, 2021. 26(9): p. 1107-1124.
[7] Betge, J., et al., The drug-induced phenotypic landscape of colorectal cancer organoids. Nature Communications, 2022. 13(1): p. 3135.
[8] Jiménez-Luna, J., et al., Artificial intelligence in drug discovery: recent advances and future perspectives. Expert Opinion on Drug Discovery, 2021. 16(9): p. 949-959.
[9] Yang, X., et al., A live-cell image-based machine learning strategy for reducing variability in PSC differentiation systems. Cell Discovery, 2023. 9(1): p. 53.
[10] Wiggins, L., et al., The CellPhe toolkit for cell phenotyping using time-lapse imaging and pattern recognition. Nature Communications, 2023. 14(1): p. 1854.
[11] Carreras-Puigvert, J. and O. Spjuth, Artificial intelligence for high content imaging in drug discovery. Current Opinion in Structural Biology, 2024. 87: 102842.
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.